Онкология
- Онкологияға арналған препараттар Препараттар
- Онкология туралы көбірек оқып біліңіз Туралы көбірек оқып біліңіз
-
ФИРМАГОН
ФИРМАГОН
(дегареликс)
(дегареликс)
Онкология
ФИРМАГОН (дегареликс)
Қазақстан Республикасы
Денсаулық сақтау министрлігі
Фармация комитеті төрағасының
2018 жылғы “05” 04
№ N014361, N014364 бұйрығымен
БЕКІТІЛГЕН
Дәрілік затты медициналық қолдану жөніндегі нұсқаулық
Фирмагон
Саудалық атауы
Фирмагон
Халықаралық патенттелмеген атауы
Дегареликс
Дәрілік түрі
Инъекция үшін ерітінді дайындауға арналған лиофилизацияланған 80 мг, 120 мг ұнтақ еріткішпен жиынтықта.
Құрамы
белсенді зат - 80 мг немесе 120 мг дегареликс (88.2 мг немесе 128.0 мг ацетат түрінде)
қосымша зат - маннитол (Е 421)
еріткіш - инъекцияға арналған су
Сипаттамасы
Корж түріндегі ақ немесе ақ дерлік түсті лиофилизат
Фармакотерапиялық тобы
Ісікке қарсы препараттар және имуномодуляторлар. Ісікке қарсы гормональді препараттар. Гормондар антагонистері және олардың аналогтары. Гормондардың басқа да антагонистері. Дегареликс.
ATХ коды L02BX02
Фармакологиялық қасиеттері.
Фармакокинетикасы
Сіңірілуі
40 мг/мл концентрациялы 240 мг дегареликсті тері астына енгізгеннен кейін простата обыры бар пациенттерде AUC0-28 күн көрсеткіші 635 (602–668) күн*нг/мл болды, ең жоғарғы концентрациясы (Сmax) 66 (61–71) нг/мл құрады және tmax 40 (37–42) сағаттан соң байқалды. Орташа мәндері алғашқы дозасынан кейін 11–12 нг/мл және 20 мг/мл концентрациялы 80 мг демеуші дозаларынан кейін 11–16 нг/мл құрады. Дегареликстің плазмадағы Сmax демеуші дозасы үшін жартылай шығарылуының орташа кезеңі (t1/2) шамамен 29 күндік екі фазалы режимде төмендейді. Тері астына енгізгеннен кейін ұзаққа созылатын жартылай шығарылу кезеңі дегареликстің енгізілген орындарында қалыптасатын деподан өте баяу босап шығуының салдары болып табылады. Препараттың фармакокинетикалық параметрлері оның инъекцияға арналған ерітіндідегі концентрациясына байланысты. Осылайша, Сmax және биожетімділгінің концентрациясы артқан сайын төмендеу үрдісі бар, сондықтан ұсынылғанынан өзге концентрациясын қолданбау керек.
Таралуы
Егде жастағы дені сау еріктідегі таралу көлемі 1 л/кг жуықты құрады. Плазма ақуыздарымен байланысуы шамамен 90% құрады.
Mетаболизмі
Дегареликс пептидтердің гепатобилиарлық жүйе арқылы өтуі кезіндегі әдеттегі деградациясының субъектісі болып табылады, оның көп бөлігі пептидтік фрагменттер түрінде нәжіспен бөлініп шығады. Тері астына енгізгеннен кейін қан плазмасында фармакологиялық белсенді метаболиттері анықталған жоқ. In vitro зерттеулер, дегареликстің адамның CYP450 цитохромы жүйесі үшін субстрат болып табылмайтындығын көрсетті.
Шығарылуы
Дені сау ерлерде дегареликстің вена ішіне бір дозасының шамамен 20–30%-ы бүйрекпен шығарылады. 70–80%-ы гепатобилиарлық жүйе арқылы шығарылады деп шамаланады. Бір реттік вена ішіне дозасын (0,864–49,4 мкг/кг) енгізген кездегі дегареликстің клиренсі егде жастағы дені сау ерлерде дене салмағына 35–50 мл/сағ/кг құрады.
Пациенттердің жекелеген топтары
Бүйрек функциясының бұзылулары бар пациенттер
Бүйрек функциясының бұзылулары бар пациенттердің қатысуымен фармакокинетикалық зерттеулер жүргізілген жоқ. Бүйрекпен өзгеріссіз күйде дегареликстің енгізілген дозасының бар болғаны 20–30%-ы шығарылады. ІІІ фазадағы зерттеудің деректері бойынша жүргізілген фармакокинетикасының популяциялық талдауы, ауырлығы жеңіл немесе орташа дәрежедегі бүйрек жеткіліксіздігі бар пациенттерде дегареликстің клиренсі 23%-ға төмендейтінін көрсетті, сондықтан ауырлығы жеңіл немесе орташа дәрежедегі бүйрек жеткіліксіздігі бар пациенттерге дозасын таңдау ұсынылмайды. Ауыр бүйрек жеткіліксіздігі бар пациенттер туралы деректер шектеулі, сондықтан мұндай пациенттерге қатысты ерекше сақтық таныту керек.
Бауыр функциясының бұзылулары бар пациенттер
Дегареликс бауыр функциясының ауырлығы жеңіл және орташа дәрежедегі жеткіліксіздігі бар пациенттердің қатысуымен жүргізілген фармакокинетикалық зерттеудің барысында зерттелді. Бауыр функциясының бұзылулары бар пациенттерде дені сау еріктілермен салыстырғанда әсерінің күшею белгілері байқалған жоқ. Ауырлығы жеңіл және орташа дәрежедегі бауыр жеткіліксіздігі бар пациенттерге дозасын таңдау қажет емес. Ауыр бауыр жеткіліксіздігі бар пациенттерге қолданылуы зерттелген жоқ, сондықтан пациенттердің бұл тобына қатысты сақтық шараларын қадағалау керек.
Фармакодинамикасы
Дегареликс – гонадотропин-рилизинг-гормонының селективті антагонисі, ол гипофиздің гонадотропин-рилизинг-гормоны (ГнРГ) рецепторларымен бәсекелес және қайтымды байланысады, гонадотропиндердің, лютеиндеуші гормон (ЛГ) мен фолликула стимуляциялаушы гормонның (ФСГ) босап шығуын жылдам төмендетеді, және сол арқылы, аталық бездерден тестостеронның секрециялануын индукциялайды. Простата карциномасы андрогенге сезімтал болып табылады және андрогендер көзін жоятын емдеуге жауап береді. ГнРГ агонистеріне қарағанда, гонадотропин-рилизинг-гормонының блокаторлары ары қарай тестостерон лықсуымен, ісіктің өсуін стимуляциялаумен, емдеу басталғаннан кейін симптомдарының өршу әлеуетімен жүретін ЛГ лықсуын индукцияламайды.
Артынан ай сайынғы 80 мг демеуші дозасы енгізілетін 240 мг Фирмагонды бір рет енгізу ЛГ, ФСГ және, демек, тестостерон деңгейін де жылдам төмендетеді. Плазмадағы дигидротестостерон (ДГТ) концентрациясы да, тестостерон концентрациясы сияқты төмендейді.
Фирмагон тестостерон секрециясы бәсеңдеуінің 0,5 нг/мл медициналық кастрация деңгейінен төмен деңгейге жетуі және ұстап тұру үшін тиімді. Айына 80 мг демеуші дозасы пациенттердің 97%-ында кемінде бір жыл бойы тестостерон секрециясының тұрақты бәсеңдеуіне алып келеді.
Фирмагонмен емдеу барысындағы қайталанған инъекциядан кейін тестостеронның микроауытқулары байқалған жоқ. Бір жыл емдеуден кейінгі тестостеронның орташа деңгейі 0,087 нг/мл құрады (0,06–0,15 интерквартильді аралық), N = 167.
Қан сарысуындағы тестостерон деңгейінің (T) ≤0,5 нг/мл жетуі
Фирмагон тестостерон супрессиясына жылдам жету үшін тиімді, 1 кестені қараңыз.
1 кесте
Емдеу басталғаннан кейін T≤0,5 нг/мл деңгейіне жеткен пациенттердің пайызы
|
Емдеу кезеңі |
Дегареликс 240/80 мг |
Лейпрорелин 7,5 мг |
|
1 күн |
52 % |
0 % |
|
3 күн |
96 % |
0 % |
|
7 күн |
99 % |
1 % |
|
14 күн |
100 % |
18 % |
|
28 күн |
100 % |
100 % |
Тестостерон ауытқуларының ескертпелері
Ауытқулар тестостеронның, алғашқы 2 апта бойы бастапқысынан ≥15%-ға артық деңгейі ретінде анықталды.
Дегареликспен ем қабылдаған пациенттердің ешқайсысында тестостеронның ауытқулары болған жоқ; тестостерон деңгейінің 3-ші күні 94%-ға орташа төмендеуі байқалды. Лейпрорелинмен ем қабылдаған пациенттердің көпшілігінде тестостеронның ауытқулары болды;
тестостерон деңгейінің 3-ші күні 65%-ға орташа жоғарылағаны байқалды.
Бұл айырмашылықтың статистикалық маңызы болды (p <0,001).
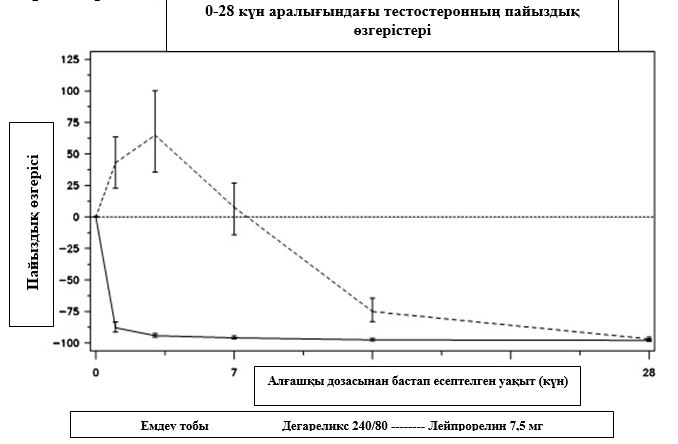
1 диаграмма.
Тестостеронның емдеу тобындағы 28 күнге дейінгі бастапқы деңгейіне қатысты пайыздық өзгерісі (интерквартильді аймақтары бар медиана)
Зерттеудің бастапқы ақырғы нүктесі тестостерон супрессиясының дегареликспен немесе лейпрорелинмен бір жыл емдеуден кейінгі деңгейі болды. Дегареликс үшін лейпрорелинмен және антиандрогенмен салыстырғанда, емдеудің бастапқы сатысында клиникалық нәтиже көрсетілген жоқ.
Тестостеронның қалпына келуі
Жергілікті емдеуден (көбінесе радикальді простатэктомия мен сәулемен емдеуден) кейін, Фирмагон жеті айлық қадағалау кезеңінен кейін жеті ай бойы енгізілген, ПСА деңгейі жоғары пациенттердің қатысуымен зерттеу жүргізілді. Тестостеронның қалпына келуіне дейінгі орташа уақыт (> 0,5 нг/мл, бұл кастрациядан кейінгі деңгейінен артық) емдеуді тоқтатқаннан кейін 112 күнді құрады (қадағалау кезеңін басталғаннан бастап есептелді, яғни соңғы инъекциядан кейінгі 28 күн). Тестостеронның >1,5 нг/мл деңгейіне жеткенге дейінгі орташа уақыт (бұл қалыпты ауқымының төменгі шегінен артық) 168 күнді құрады.
Ұзақ мерзімді әсері
Зерттеу кезіндегі нәтижелі реакция 28 күні медициналық кастрацияға жету және оны 364 күнге дейін ұстап тұру ретінде анықталды, сонымен қатар тестостеронның бір реттік концентрациясының бірде-біреуі 0,5 нг/мл асқан жоқ.
2 кесте
28 күннен 364 күнге дейін ≤0,5 нг/мл тестостерон деңгейіне жетудің жиынтық ықтималдылығы
|
Препараттың атауы Пациенттердің саны |
Дегареликс 240/80 мг N=207 |
Лейпрорелин 7,5 мг N=201 |
|
Клиникалық жауап бар пациенттер саны |
202 |
194 |
|
Жауаптың жиілігі (сенім аралықтары)*
|
97,2 % (93,5; 98,8 %) |
96,4 % (92,5; 98,2 %) |
* Топ аясындағы Каплан-Майер бағалаулары
ПСА деңгейінің төмендеуі
Клиникалық зерттеу барысында ісіктердің деңгейі тікелей өлшенген жоқ, алайда қатерсіз ісіктердің жанама әсері байқалды, бұл ПСА орташа деңгейінің дегареликсті 12 ай қолданғаннан кейін 95%-ға төмендегенін растайды.
Зерттеу барысында бастапқы деңгейдегі ПСА орташа деңгейі мынадайды құрады:
- 240/80 мг – 19,8 нг/мл дегареликспен емдеу тобы үшін (интерквартильді аймақ: P25 9,4 нг/мл, P75 46,4 нг/мл)
- 7,5 мг – 17,4 нг/мл лейпрорелинмен емдеу тобы үшін (интерквартильді аймақ: P25 8,4 нг/мл, P75 56,5 нг/мл).
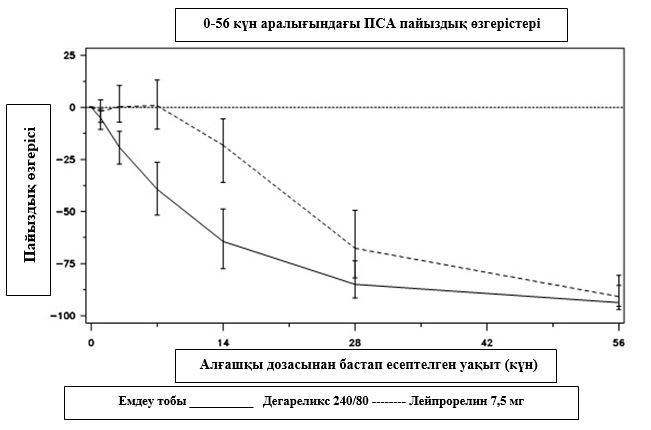
2 диаграмма.
Емдеу тобындағы ПСА 56-ші күнге дейінгі бастапқы деңгейіне қатысты пайыздық өзгерісі (интерквартильді аймақтармен медиана)
Бұл айырмашылық (p <0,001) 14-ші және 28-ші күндері жоспарда алдын-ала қарастырылған айнымалы талдау үшін статистикалық тұрғыдан маңызды болды.
ПСА деңгейлері дегареликсті енгізгеннен кейінгі екі аптадан соң 64%-ға, бір айдан соң 85%-ға және үш айдан соң 95%-ға төмендеді және бір жыл емдеу кезеңінде бәсеңдеген күйі (97%-ға жуық) қалды. 56-шы күннен 364-нші күнге дейінгі аралықта дегареликс пен салыстыру препараты арасында бастапқы деңгейіне қатысты пайыздық өзгерістерінде елеулі айырмашылықтар болған жоқ.
Қуықасты безінің көлеміне әсері
Дегареликсті қолданып жүргізілген 3 айлық емдеу аясында (240/80 мг дозалау режимі), трансректальді ультрадыбыстық зерттеу (ТРУДЗ) көмегімен алынған өлшеулерге сәйкес, сәулемен емдеудің алдында гормональді емдеуді қажет ететін пациенттерде, медициналық кастрацияға үміткер пациенттерде қуықасты безі көлемінің 37%-ға кішірейгені байқалды. Қуықасты безі көлемінің кішіреюі гозерелин мен антиандрогендік қорғанысты қолданудан алынған нәтижеге ұқсас болды.
QT/QTc аралықтарына әсері
Фирмагон мен лейпрорелиннің салыстырмалы растау зерттеулері барысында ЭКГ мезгіл-мезгіл жүргізіліп отырды. Екі емдеу нұсқасы да, пациенттердің шамамен 20%-ында 450 мс асатын QT/QTc аралықтарын көрсетті. Зерттеу аяқталғанға дейін QTc ұзындығының бастапқы мәнмен салыстырғанда орташа артуы Фирмагон үшін 12,0 мс, ал лейпрорелин үшін – 16,7 мс құрады.
Дегареликске антиденелер
Фирмагонмен емдеуден кейін бір жыл ішінде дегареликске антиденелердің дамуы 10% пациентте және Фирмагонмен 5,5 жылға дейінгі кезең бойына емдеуден кейін 29% пациентте байқалды. Фирмагонмен емдеудің тиімділігі немесе қауіпсіздігіне 5,5 жылға дейінгі кезең бойына емдеуден кейін антиденелер түзілуінің әсер етеуінің белгілері жоқ.
Қолданылуы
- ересек ерлердегі қуықасты безінің жайылған, гормонға тәуелді обырында
Қолдану тәсілі және дозалары
Дозасы
|
Бастапқы дозасы |
Айына 1 реттік демеуші дозасы |
|
Әрқайсысы 120 мг-ден екі теріастылық инъекция түрінде 240 мг |
Теріастылық инъекция түрінде 80 мг |
Алғашқы демеуші дозасын бастапқы дозасын енгізгеннен кейін 1 айдан соң енгізу керек.
Фирмагонның емдік әсеріне қан сарысуындағы клиникалық параметрлерін және ПСА деңгейін өлшеу арқылы мониторинг жүргізу керек. Клиникалық зерттеулер, тестостеронның (Т) супрессиясы бастапқы дозасын енгізген бойда бірден орын алатындығын көрсетті: пациенттердің 96%-ында сарысудағы медициналық кастрациядан кейінгі деңгейге сәйкес келетін (T≤0,5 нг/мл) тестостерон – үш күннен соң және бір айдан соң 100%-ында. Демеуші дозасын қолданумен 1 жылға дейін созылатын ұзақ емдеу, пациенттердің 97%-ында тестостероның бәсеңдеген деңгейі тұрақты (T≤0,5 нг/мл) екенін көрсетеді.
Егер клиникалық әсері жеткіліксіз болса, сарысудағы тестостерон деңгейінің жеткілікті төмендетілгеніне көз жеткізу керек.
Фирмагон тестостерон деңгейінің жоғарылауын индукцияламайтындықтан, емдеудің басындағы тестостерон лықсуынан қорғаныс ретінде антиандрогендік препараттарды тағайындау қажет емес.
Енгізу
Фирмагон тек тері астына енгізуге арналған, және оны вена ішіне енгізуге болмайды. Бұлшықет ішіне енгізілуі зерттелген жоқ, сондықтан ұсынылмайды.
Препаратты іш аймағына теріастылық инъекциялар түрінде тағайындайды. Инъекция орнын мезгіл-мезгіл ауыстырып отыру керек. Инъекцияны киіммен қысылмайтын (атап айтқанда, белге тағылатын белбеу немесе белдік аймағына енгізуге болмайды) және қабырғаларға тым жақын емес бөліктерге жүргізу керек.
Пациенттердің жекелеген топтары үшін дозасын таңдау
Егде жастағы, бауыр және бүйрек жеткіліксіздігі бар пациенттер
Егде жастағы пациенттерге немесе бауыр мен бүйректің елеусіз бұзылулары болса, дозасын таңдау қажет емес. Препаратты бүйрек пен бауырдың ауыр жеткіліксіздігі жағдайында қолдану зерттелген жоқ, сондықтан мұндай жағдайларда ерекше сақтық таныту керек.
Препаратты енгізу ережелері
Тағайындалғанынан өзгеше концентрацияларын енгізу ұсынылмайды, өйткені концентрациясы депо түзілуіне әсер етеді.
Сұйылтылған ерітінді мөлдір, ерімеген бөлшектерсіз болуы тиіс.
Сақтандыру
Құтыларды сілкімеу керек.
Фирмагон 120 мг
Қаптамада ұнтағы бар 2 құты және алдын-ала еріткіш толтырылған 2 еккіш болатындықтан, еріту емшарасын екі рет қайталау керек.
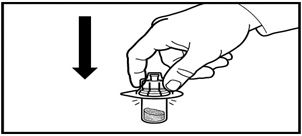
1. Құтының қақпағын ашыңыз. Адаптерді ұнтағы бар құтыға, адаптерді төмен қарай, инесі резеңке тығынын тесіп өткенше және адаптер көрсетілген орынға орныққанша баса отырып бекітіңіз.
2. Алдын-ала толтырылған еккішті поршень стерженін жалғау арқылы дайындаңыз.
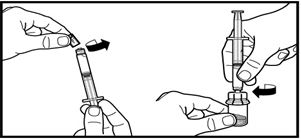
3. Алдын-ала толтырылған еккіштің қалпақшасын алып тастаңыз. Еккішті ұнтағы бар құтыға бекітіңіз және оны адаптерге бұрап кіргізіңіз. Еріткішті түгелімен ұнтағы бар құтыға құйыңыз.
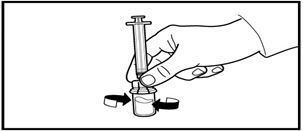
4. Еккішті адаптермен ажыратпай тұрып, сұйықтық ерімеген қоспалар мен бөлшектерсіз, мөлдір түске енгенше жайлап шайқаңыз. Егер ұнтақ құтының қабырғасында сұйықтықтың деңгейінде тұрып қалса, құтыны сәл еңкейтуге болады.
Көбік түзілуін болдырмас үшін, құтыны сілкімеңіз.
Сұйықтықтың беткейінде аздаған ауа көпіршіктерінің болуына жол беріледі. Еріту емшарасы әдетте бірнеше минутқа созылады, бірақ кей жағдайларда 15 минутқа дейін созылуы мүмкін.
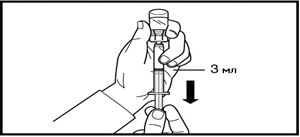
5. Құтыны төңкеріңіз және препаратты инъекцияға арналған еккіштегі белгі сызығына дейін сорып алыңыз.
Алынған көлемінің дәлдігі мен қандай-да бір ауа көпіршіктерінің жоқтығын үнемі тексеріп отырыңыз.
6. Еккішті құтының адаптерінен ажыратыңыз және тері астына терең енгізуге арналған инені бекітіңіз.
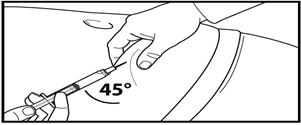
7. Тері астына терең инъекция жасаңыз.
Ол үшін іштің терісін жиырып алып, теріасты тінін сәл көтеріңіз және инені кемінде 45 градус бұрыштап терең енгізіңіз.
Сұйылтқаннан кейін бірден 120 мг Фирмагонның 3 мл баяу енгізіңіз.
8. Инъекцияны қысым түсетін, мысалы, белдік немесе белбеудің астындағы немесе қабырғаларға жақын жерлерге жасамаған дұрыс.
Тікелей көктамырға енгізбеңіз. Еккіште қанның жоқтығына көз жеткізу үшін, поршеньді өзіңізге қарай абайлап тартыңыз. Қан пайда болған жағдайда, ары қарай препаратты қолдануға болмайды. Емшараны тоқтатыңыз және инесі мен препараты бар еккішті алып тастаңыз (пациент үшін жаңа дозасын сұйылтыңыз).
Фирмагон 80 мг
Қаптаманың ішінде инъекция үшін ерітінді дайындауға арналған, ұнтағы бар 1 құты және алдын-ала еріткішпен толтырылған 1 еккіш бар.
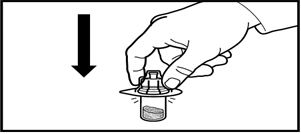
1. Құтының қақпағын ашыңыз. Адаптерді ұнтағы бар құтыға, адаптерді төмен қарай, инесі резеңке тығынын тесіп өткенше және адаптер көрсетілген орынға орныққанша баса отырып бекітіңіз.
2. Алдын-ала толтырылған еккішті поршень стерженін жалғау арқылы дайындаңыз.
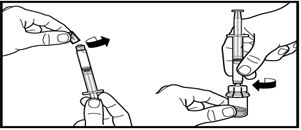
3. Алдын-ала толтырылған еккіштің қалпақшасын алып тастаңыз. Еккішті ұнтағы бар құтыға бекітіңіз және адаптерге бұрап кіргізіңіз. Еріткішті түгелімен ұнтағы бар құтыға құйыңыз.
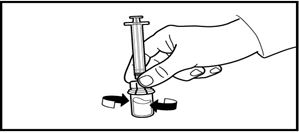
4. Еккішті адаптермен ажыратпай тұрып, сұйықтық ерімеген қоспалар мен бөлшектерсіз, мөлдір түске енгенше жайлап шайқаңыз. Егер ұнтақ құтының қабырғасында сұйықтықтың деңгейінде тұрып қалса, құтыны сәл еңкейтуге болады.
Көбік түзілуін болдырмас үшін, құтыны сілкімеңіз.
Сұйықтықтың беткейінде аздаған ауа көпіршіктерінің болуына жол беріледі. Еріту емшарасы әдетте бірнеше минутқа созылады, бірақ кей жағдайларда 15 минутқа дейін созылуы мүмкін.
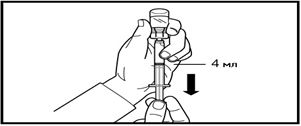
5. Құтыны төңкеріңіз және препаратты инъекцияға арналған еккіштегі белгі сызығына дейін сорып алыңыз.
Алынған көлемінің дәлдігі мен қандай-да бір ауа көпіршіктерінің жоқтығын үнемі тексеріп отырыңыз.
6. Еккішті құтының адаптерінен ажыратыңыз және тері астына терең енгізуге арналған инені бекітіңіз.
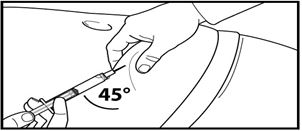
7. Тері астына терең инъекция жасаңыз.
Ол үшін іштің терісін жиырып алып, теріасты тінін сәл көтеріңіз және инені кемінде 45 градус бұрыштап терең енгізіңіз.
Сұйылтқаннан кейін бірден 80 мг Фирмагонның 4 мл баяу енгізіңіз.
8. Қысым түсетін орындарға, мысалы белдік немесе белбеудің астындағы немесе қабырғаларға жақын жерлерге инъекция жасамау керек.
Тікелей көктамырға енгізбеңіз. Еккіште қанның жоқтығына көз жеткізу үшін, поршеньді өзіңізге қарай абайлап тартыңыз. Қан пайда болған жағдайда препаратты ары қарай қолдануға болмайды. Емшараны тоқтатыңыз және инесі мен препараты бар еккішті алып тастаңыз (пациент үшін жаңа дозасын сұйылтыңыз).
Еріткеннен кейін препаратты дереу енгізу керек. Сұйылтылған ерітіндінің химиялық және физикалық тұрақтылығы сұйылтқаннан кейін 2 сағат бойы сақталады.
Жағымсыз реакциялары
III фазадағы дәлелдеу зерттеуі барысында дегареликспен емдеу кезінде анағұрлым жиі байқалған жағымсыз реакциялар, тестостерон секрециясы бәсеңдеуінің күтілетін физиологиялық әсерлерімен, соның ішінде қан кернеулерімен және дене салмағының артуымен (бір жыл бойы ем қабылдаған пациенттердің сәйкесінше 25 % және 7%-ында анықталды) байланысты әсерлер, немесе инъекция орнындағы жағымсыз әсерлер болды. Өтпелі қалтырау, қызба немесе тұмау тәрізді жағдай препаратты қабылдағаннан кейін бірнеше сағат ішінде тіркелді (пациенттердің сәйкесінше 3%, 2% және 1%-ында).
Негізінен ауыру және эритемамен білінген инъекция орнындағы жағымсыз реакциялар, сәйкесінше 28% және 17% пациентте анықталды, ісінулер (6%), индурация (4%) және түйіндердің (3%) түзілу жиілігі аздау болды. Бұл құбылыстар көбінесе старттық дозасы аясында байқалды, ал 80 мг дозасымен демеуші ем жүргізу кезінде бұл құбылыстардың жиілігі 100 инъекцияда ауыру үшін 3 және эритема, ісіну, индурация және түйіндердің түзілуі үшін <1 болды. Аталған реакциялар негізінен өтпелі, айқындық дәрежесі жеңіл және орташа болды және аса сирек жағдайларда ғана емдеуді тоқтатуға алып келді (<1%). Инъекция орнындағы инфекциялар, инъекция орнындағы абсцесс немесе некроз сияқты хирургиялық емдеуді немесе дренаждауды қажет ететін инъекция орнындағы күрделі реакциялар өте сирек білініп отырды.
Жағымсыз әсерлері ағзалар жүйелері бойынша және туындау жиілігіне қарай бөлінген: өте жиі (≥1/10); жиі (≥1/100 - <1/10 дейін); жиі емес (≥1/1000 - <1/100 дейін); сирек (≥1/10000 - <1/1000 дейін).
Маркетингтен кейінгі зерттеу барысындағы және емдеу жүргізілген пациенттерде хабарланған жағымсыз реакциялар (II және III фазадағы зерттеулер).
Қан және лимфа жүйесі тарапынан.
Жиі: анемия*.
Сирек: нейтропениялық қызба.
Иммундық жүйе тарапынан.
Жиі емес: аса жоғары сезімталдық.
Сирек: анафилаксиялық реакциялар.
Метаболизм бұзылулары.
Жиі: дене салмағының жоғарылауы*.
Жиі емес: гипергликемия/қант диабеті, холестерин деңгейінің жоғарылауы, дене салмағының төмендеуі, тәбеттің төмендеуі, қандағы кальций деңгейінің өзгеруі.
Жүйке жүйесі тарапынан.
Жиі: бас айналуы, бас ауыруы, ұйқысыздық.
Жиі емес: гипестезия, психикалық бұзылулар, депрессия, либидо төмендеуі*.
Көру мүшелері тарапынан.
Жиі емес: көру жітілігінің төмендеуі.
Жүрек тарапынан.
Жиі емес: жүрек аритмиясы (соның ішінде, жүрекшелердің фибрилляциясы), жүректің қағуы, QT аралығының ұзаруы*.
Сирек: миокард инфарктісі, жүрек жеткіліксіздігі.
Қантамырлар тарапынан.
Өте жиі: қан кернеулері*.
Жиі емес: артериялық гипертензия, вазовагальді реакциялар (гипотензияны қоса).
Тыныс алу жүйесі мен кеуде қуысы ағзалары тарапынан.
Жиі емес: диспноэ.
Асқазан-ішек жолы тарапынан.
Жиі: жүрек айнуы, диарея.
Жиі емес: іштің қатуы, құсу, іш тұсындағы жайсыздық, абдоминальді ауыру, ауыздың құрғауы.
Гепатобилиарлық жүйе тарапынан.
Жиі: бауыр трансаминазалары деңгейінің жоғарылауы.
Жиі емес: билирубин деңгейінің жоғарылауы, сілтілік фосфатаза деңгейінің жоғарылауы.
Тері мен теріасты шелі тарапынан.
Жиі: гипергидроз (соның ішінде түнде терлеу)*, бөртпе.
Жиі емес: есекжем, қышыну, түйіндік бөртпе, алопеция, эритема.
Қаңқа-бұлшықет жүйесі мен дәнекер тіндер тарапынан.
Жиі: сүйек-бұлшықет ауыруы және жайсыздық.
Жиі емес: остеопороз/остеопения, артралгия, бұлшықет әлсіздігі, бұлшықет түйілулері, буындардың ісінуі/құрысуы.
Несеп шығару жүйесі тарапынан.
Жиі емес: поллакиурия, тез арада несепке қысылу, дизурия, никтурия, бүйрек жеткіліксіздігі, несепті ұстай алмау.
Ұрпақ өрбіту жүйесі мен сүт бездері тарапынан.
Жиі: эректильді дисфункция*, аталық бездердің атрофиясы*, гинекомастия*.
Жиі емес: жамбастың ауыруы, тестикулярлық ауыру, кеуденің ауыруы, жыныс мүшелері аймағындағы тітіркену, эякуляция бұзылуы.
Жалпы бұзылулар және енгізген жердегі реакциялар.
Өте жиі: инъекция орнындағы реакциялар.
Жиі: қалтырау, қызба, қатты қажу*, тұмау тәрізді жағдай.
Жиі емес: шеткері ісінулер, дімкәстік.
* Тестостерон секрециясы бәсеңдеуінің физиологиялық салдарлары.
Маркетингтен кейінгі кезеңде анафилаксияны, есекжем мен ангионевроздық ісінуді қоса, аса жоғары сезімталдық реакциялары туралы сирек хабарламалар болды.
Зертханалық көрсеткіштердің өзгерістері.
Зертханалық көрсеткіштердің өзгерістері III фазадағы дәлелдеу зерттеуінде бір жыл ішінде байқалды және дегареликс үшін де, салыстыру препараты ретінде пайдаланылған ГнРГ-агонисі лейпрорелин үшін де бірдей ауқымда болды. Екі препаратпен де емдеу аясында бауыр трансаминазаларының (АЛТ, АСТ және ГГТ) айтарлықтай артуы (қалыптың жоғарғы шегінен 3 есе артық) емдеуге дейінгі мәндері қалыпты болған 2-6% пациентте білінді. Гематологиялық көрсеткіштер – гематокрит (≤0,37) пен гемоглобин (≤115 г/л) мәндерінің елеулі азаюы – бастапқыдағы көрсеткіштері қалыпты сәйкесінше 40% және 13-15% пациентте байқалды. Гематологиялық көрсеткіштері мәнінің бұл азаюы қаншалықты дәрежеде простата обырына байланысты екендігі және мұның қаншалықты дәрежеде андрогендік блокаданың салдары болғандығы әзірше белгісіз. Емдеу басталғанға дейін мәндері қалыпты болған пациенттерде калий (≥ 5,8 ммоль/л), креатинин (≥ 177 мкмоль/л) және мочевина (≥ 10,7 ммоль/л) деңгейінің нормадан ауытқуы дегареликсті қабылдаған 6%, 2% және 15% пациентте, және лейпрорелинді қабылдаған сәйкесінше 3%, 2% және 14% пациентте білінді.
ЭКГ өзгерістері.
III фазадағы дәлелдеу зерттеуінде бір жыл ішінде байқалған ЭКГ өзгерістері дегареликс үшін де, салыстыру препараты ретінде пайдаланылған ГнРГ-агонисі лейпрорелин үшін де бірдей ауқымда болды. Дегареликсті қабылдаған 1%-дан кем пациенттерде және 7,5 мг лейпрорелинді қабылдаған 2% пациенттерде QTcF ≥ 500 мс ұзарғаны анықталды. Зерттеу аяқталғанға дейін QTcF ұзындығының бастапқы мәндерімен салыстырғанда орташа ұзаруы дегареликс үшін 12 мс, ал лейпрорелин үшін – 16,7 мс құрады.
Дегареликстің қуықасты безінің обырын емдеу кезінде алынған Сmax мәнінен 3-4 есе артық Сmax 222 нг/мл орташа мәніне жететін 60 минут бойғы көктамырішілік инфузиясын қабылдаған дені сау еріктілерде, дегареликстің өзінің жүрек реполяризациясына (QTcF), жүректің жиырылу жиілігіне, АВ-өткізгіштікке, жүрек деполяризациясына немесе T- немесе U-толқындардың морфологиясына әсерінің жоқтығы мұқиятталған QT-зерттеуі барысында расталды.
Қолдануға болмайтын жағдайлар
- дегареликске немесе препараттың кез келген басқа компонентіне аса жоғары сезімталдық
- әйелдерді емдеу үшін
- балалар мен 18 жасқа дейінгі жасөспірімдерге.
Дәрілермен өзара әрекеттесуі
Басқа дәрілік заттармен өзара әрекеттесулеріне зерттеулер жүргізілген жоқ.
Андрогендермен депривациялық ем QTc аралығын ұзартуы мүмкін болғандықтан, Фирмагонды QTc аралығын ұзартуы мүмкін немесе ІА класының (хинидин, дизопирамид) немесе III класының аритмияға қарсы дәрілер (амиодарон, соталол, дофетилид, ибутилид), сондай-ақ метадон, моксифлоксацин, психозға қарсы дәрілер сияқты, иірме жіп тәрізді қарыншалық тахикардияны индукциялауға қабілетті препараттармен бір мезгілде қолдану мұқият бағалауды қажет етеді.
Дегареликс адамда CYP450 цитохромы жүйесі үшін субстрат болып табылмайды және қандай-да бір елеулі мөлшерлерде in vitro CYP1A2, CYP2В6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 немесе CYP3A4/5 белсенділендіреді, бірақ тежемейді. Бұдан өзге, дегареликс дәрілік заттардың шығарылуы мен сіңірілуінің қандай-да бір сәйкесінше тасымалдағыштарымен өзара әрекеттеспейді.
Осылайша, метаболизмі аталған изоферменттермен байланысты басқа дәрілік заттармен клиникалық маңызды фармакокинетикалық өзара әрекеттесулерінің ықтималдығы аз.
Айрықша нұсқаулар
Фирмагон тек тері астына енгізуге арналған.
QT/QTc аралығына әсері
Ұзаққа созылатын андрогендік депривациялық ем QT аралығының ұзаруына алып келуі мүмкін.
Фирмагон мен лейпрорелинді салыстыруға қатысты зерттеулер барысында ЭКГ ай сайын жүргізілді. Екі емдеу режимінде де 20% пациентте 450 мс және дегареликс пен лейпрорелинді қабылдаған 1 және 2% пациентте – 500 мс асатын QT және QTc аралығы анықталды.
QT аралығы 450 мс асатын пациенттерде, иірме жіп тәрізді қарыншалық тахикардиясы немесе оның туындау қаупі бар пациенттерде, сондай-ақ QT аралығын ұзартуы мүмкін дәрілік заттарды қатарлас қабылдап жүрген пациенттерде Фирмагонның әсері зерттелген жоқ. Осылайша, мұндай пациенттерде Фирмагон үшін қауіп/пайда арақатынасы мұқият бағалауды қажет етеді.
QT егжей-тегжейлі зерттеу, дегареликстің өзі QT/QTc аралығына әсер етпейтіндігін көрсетті.
Бауырдың зақымдануы
Белгілі немесе күмәнді бауыр аурулары бар пациенттер дегареликс қолданылған ұзақ мерзімді клиникалық зерттеулерге қатысқан жоқ. АСТ және АЛТ деңгейінің билирубин деңгейінің жоғарылауымен немесе клиникалық симптомдармен қатар жүрмейтін елеусіз жоғарылағаны байқалады. Емдеу кезінде бауыр функциясына жүргізілген мониторинг бауыр тарапынан белгілі немесе болуы мүмкін бұзылулары бар пациенттерде талапқа сай. Дегареликстің фармакокинетикасы бауырдың жеңіл және орташа дәрежедегі зақымдануы бар пациенттерде бір рет енгізгеннен кейін зерттелді.
Бүйректің зақымдануы
Препаратты бүйрек функциясының ауыр бұзылулары бар пациенттерге сақтықпен тағайындау керек.
Аса жоғары сезімталдық
Фирмагон анамнезінде емделмеген ауыр демікпесі, анафилаксиялық реакциялары, ауыр есекжемі, ангионевроздық ісінуі бар пациенттерде зерттелген жоқ.
Сүйектердің тығыздығының өзгеруі
Медициналық әдебиеттерде орхиэктомияны бастан өткерген немесе ГнРГ агонистерімен ем қабылдаған пациенттерде сүйектер тығыздығының төмендегені байқалады, бұл ерлердегі тестостерон супрессиясының сүйек тінінің тығыздығына әсер ететінін көрсетеді. Фирмагонмен емдеу үдерісінде сүйек тінінің тығыздығы өлшенген жоқ.
Глюкозаға төзімділік
Орхиэктомия жүргізілген, сондай-ақ, ГнРГ агонистерімен ем жүргізілген пациенттерде, глюкозаға төзімділіктің төмендегені байқалды. Диабет дамуы немесе ағымы асқынуы мүмкін. Осылайша, диабеті бар пациенттерде депривациялық ем қабылдау кезінде қандағы глюкоза деңгейіне жиірек мониторинг жүргізу қажет. Фирмагонның инсулин мен глюкоза деңгейлеріне әсерлері зерттелген жоқ.
Жүрек-қантамыр аурулары
Медициналық оқулықтарда андрогендік депривациялық ем жүргізілген пациенттердегі инсульт және миокард инфарктісі сияқты жүрек-қантамыр аурулары туралы хабарланды. Сондықтан барлық жүрек-қантамырлық қауіп факторлары ескерілуі тиіс.
Фертильділік
Фирмагон тестостерон секрециясының бәсеңдеуі сақталған кезде, ерлердегі фертильділікті бәсеңдетуі мүмкін.
Жүктілік немесе бала емізу кезеңінде қолданылуы.
Препарат әйелдерге қолданылмайды.
Көлік құралын немесе қауіптілігі зор механизмдерді басқару қабілетіне әсер ету ерекшеліктері
Фирмагон көлік құралдарын басқару және механизмдермен жұмыс жасауға әсер етпейді немесе әсері елеусіз. Қажу мен бас айналуы, көлік құралын басқару және механизмдермен жұмыс жасау қабілетіне әсер етуі мүмкін анағұрлым жиі кездесетін жағымсыз реакциялар болып табылады.
Артық дозалануы
Симптомдары: артық дозаланған жағдайлары жөнінде клиникалық деректер жоқ.
Емі: пациентті қадағалау, қажет болса симптоматикалық ем.
Шығарылу түрі және қаптамасы
Препарат резеңке тығындармен тығындалған және алюминий қалпақшалармен қаусырылған, қорғағыш пластмасса қақпақтары бар, түссіз шыныдан жасалған құтыларға салынған.
4.2 мл (80 мг дозасы үшін) еріткіштен сыйымдылығы 5 мл, 4.0 мл таңбасы бар еккіштерге құйылады.
3.0 мл (120 мг дозасы үшін) еріткіштен сыйымдылығы 5 мл, 3.0 мл таңбасы бар еккіштерге құйылады.
Ұнтағы бар 3 құтыдан, алдын ала толтырылған еріткіші бар 3 еккіштен, 3 поршень стерженінен, құтыға арналған 3 адаптерден және 3 инеден (80 мг дозасы үшін) немесе ұнтағы бар 2 құтыдан, алдын ала толтырылған еріткіші бар 2 еккіштен, 2 поршень стерженінен, құтыға арналған 2 адаптерден және 2 ине (120 мг дозасы үшін) медициналық қолдану жөніндегі мемлекеттік және орыс тілдеріндегі нұсқаулықпен бірге картоннан жасалған қорапшаға салынады.
Сақтау шарттары
25 °С-ден аспайтын температурада, түпнұсқалық қаптамасында сақтау керек.
Мұздатып қатыруға болмайды! Сұйылтылған ерітіндінің химиялық және физикалық тұрақтылығы сұйылтқаннан кейін 2 сағат бойы сақталады.
Балалардың қолы жетпейтін жерде сақтау керек!
Сақтау мерзімі
3 жыл.
Жарамдылық мерзімі өткеннен кейін қолдануға болмайды.
Дәріханалардан босатылу шарттары
Рецепт арқылы
Өндіруші және Тіркеу куәлігінің ұстаушысы
Ферринг ГмбХ, Германия
Wittland 11
24109 Kiel, Germany
Қазақстан Республикасы аумағында тұтынушылардан дәрілік заттың сапасына қатысты шағымдарды (ұсыныстарды) қабылдайтын, дәрілік заттың тіркеуден кейінгі қауіпсіздігін қадағалауға жауапты ұйымның атауы, мекенжайы және байланыс деректері (телефон, факс, электронды поштасы)
«Ферринг Фармацевтикалс СА» Қазақстан Республикасындағы өкілдігі
Қазақстан Республикасы
Алматы қ., 050022
Наурызбай батыр к-сі, 99/1 үй, 41Б кеңсе
Тел.: +7(727) 311 5447, факс: +7(727) 311 5287