ҚРТ
-
ДЕКАПЕПТИЛ
ДЕКАПЕПТИЛ
(трипторелин)
(трипторелин)
ҚРТ -
МЕНОГОН
МЕНОГОН
(менотропин)
(менотропин)
ҚРТ -
МЕНОПУР 75
МЕНОПУР 75
(менотропин)
(менотропин)
ҚРТ -
МЕНОПУР 600-1200
МЕНОПУР 600-1200
(менотропин)
(менотропин)
ҚРТ -
РЕКОВЕЛЛЬ
РЕКОВЕЛЛЬ
(фоллитропин дельта)
(фоллитропин дельта)
ҚРТ - препараттың әсер етуші затына немесе қосымша заттарының кез келгеніне жоғары сезімталдық;
- гипофиз немесе гипоталамус ісіктері;
- аналық без, жатыр немесе сүт бездерінің обыры;
- шығу тегі белгісіз қынаптық қан кету;
- поликистозды аналық бездер синдромымен байланысты емес кисталардың болуы немесе аналық бездердің көлемі үлкеюі;
- аналық бездер функциясының бастапқы жеткіліксіздігі;
- жүктілікпен үйлеспейтін жыныс мүшелерінің даму ақаулары;
- жүктілікпен үйлеспейтін жатыр миомасы
- 18 жасқа дейінгі балалар;
- жүктілік және емшек емізу кезеңі
- Дайындық сатысы
- Қолыңызды сабындап жуыңыз.
- Шприц-қаламның зақымданбағанын тексеріңіз. Зақымданғанын анықтаған жағдайда (мысалы, қатты беткейге соғылған немесе құлаған жағдайда), бұл шприц-қаламды пайдалану ұсынылмайды.
- Картридждің ішіндегісінің мөлдірлігін және жүзінді бөлшектердің бар-жоғын тексеріңіз. Егер ерітінді мөлдір емес немесе ішінде жүзінді қоспалар бар болса, бұл препаратты қолданбаған жөн.
- Қажетті дозадағы препараттың пайдаланылуына көз жеткізіңіз.
- Шприц-қаламның заттаңбасындағы жарамдылық мерзімін тексеріңіз.
- Қажет болуы мүмкін барлық заттарды таза тегіс беткейге орналастырыңыз:
- Рековелль препараты бар алдын ала толтырылған шприц-қаламды инъекцияға дайындау
- Жаңа ине алыңыз (Рековелль препараты бар алдын ала толтырылған шприц-қалам бар қаптамада болатын бір реттік инелерді ғана пайдаланыңыз).
- Иненің сыртқы қалпақшасында алғашқы ашылуын бақылау заттаңбасының бар екенін және бүлінбегенін тексеріңіз. Егер иненің сыртқы қалпақшасының алғашқы ашылуын бақылау заттаңбасы бүлінген немесе жоқ болса, бұл инені пайдаланбай, оны тастап, басқасын алыңыз. Пайдаланбаған инелерді олардың сыртқы қалпақшасын шешпестен жою керек.
- Алғашқы ашылуын бақылау заттаңбасын алып тастаңыз.
- Присоедините Сыртқы қалпақшаны шприц-қаламға жалғаңыз және сыртыл естілгенше басыңыз.
- Сыртқы қалпақшаны еппен тартып, шешіп алыңыз.
- Шприц-қаламды инесін жоғары қарата ұстап, иненің ішкі қалпақшасын абайлап шешіп алып, тастаңыз.
- Егер Сіз ұсақ сұйықтық тамшыларын көріп тұрсаңыз, 3-бөлімді қараңыз: Дәрігер тағайындаған дозаны белгілеу.
- Дозаны бақылау терезесінде доза индикаторы бар сызығында тамшы түріндегі белгі пайда болғанша дозатор тұтқасын сағат тілі бойынша абайлап бұрыңыз. Егер қажетті белгіні өткізіп алсаңыз, дозатор тұтқасын кері бұруға болады.
- Қаламды инесін жоғары қарата ұстап, препарат бар контейнерді сәл тықылдатыңыз.
- Дозатор батырмасын түбіне дейін басыңыз. Иненің ұшында ұсақ сұйықтық тамшысы пайда болады. Дозаны бақылау терезесінен «0» көрінетінін тексеріңіз.
- Егер сұйықтық тамшысы пайда болмаса, әрекетті қайталаңыз. Егер 5 әрекеттен кейін тамшы пайда болмаса, инені ауыстырыңыз толтыру әрекетін қайталаңыз.
- Дәрігер тағайындаған дозаны белгілеу
- Дозаны алу үшін дозатор сақинасын өзіңізден әрі қарай бұраңыз (сағат тілімен).
- Дозаны түзету үшін дозатор сақинасын өзіңізге қарай бұраңыз (сағат тіліне қарсы).
- Дозаны енгізу
- Шприц-қаламды инъекция барысында дозаны бақылау терезесі көрінетіндей етіп ұстаңыз
- Теріні қысы ұстап, инені толығымен теріге баяу енгізіңіз.
- Дозатор тұтқасын түбіне дейін басыңыз және оны осы қалыпта инъекция аяқталғанша ұстап тұрыңыз.
- Толық доза енгізілгені кепілді болу үшін дозатор батырмасын басқан күйі дозаны бақылау терезесінен «0» көрінгенше ұстап тұрыңыз, содан соң тағы 5 секунд (5-ке дейін баяу санап) күтіңіз.
- Дозаны бақылау терезесінде көрінетін сан кері 0-ге оралады.
- Кем дегенде 5 секунд кідіріп, дозатор батырмасын басқан күйінен босатып, инені теріден шығарып алыңыз.
- Қажет болса инъекция орнына дәкеден жасалған сүрткіні немесе мақталы тампонды басыңыз.
- Әрбір инъекцияны енгізу үшін әрқашанда жаңа инені пайдаланыңыз.
- Инъекцияны енгізгеннен кейін
- Дозаны бақылау терезесінде жаңа шприц-қалам арқылы енгізу керек болатын препараттың жетпей тұрған дозасы көрсетіледі.
- Жаңа шприц-қалам пайдаланып, 1 («Дайындық сатысы») және 2 («Рековелль препараты бар алдын ала толтырылған шприц-қаламын инъекцияға дайындау») бөлімдерде баяндалған әрекеттерді қайталаңыз.
- Сіз дозалау күнделігіне жазып қойған («жаңа шприц-қаламға арналған доза» = «тағайындалған доза» - «ескі шприц-қаламда қалған доза») препараттың жетпейтін дозасына немесе алдыңғы қалам терезесінде көрсетілген санға сәйкес келетін дозаны белгілеңіз де, инъекцияны енгізіңіз.
- Иненің сыртқы қалпақшасын тегіс беткейге қойыңыз.
- Рековелль препараты бар алдын ала толтырылған шприц-қаламын бір қолыңызда мықтап ұстап, инені сыртқы қалпақшасына қойыңыз.
- Қатты беткейге сүйеніп, қалпақшаны сырт еткенше тарта беріңіз.
- Инені сыртқы қалпақшасынан ұстап тұрып, қалпақшаны сағат тіліне қарсы айналдырып, инені босатып алыңыз. Пайдаланылған инені абайлап утилизациялаңыз (өткір заттарға арналған контейнерге салыңыз).
- Ешқашан инені қайта пайдаланбаңыз. Ешқашан инені басқа пациенттерге бермеңіз.
- Қалпақшаны қаламға кигізіңіз.
- Қажет болса шприц-қаламның сыртқы беткейін дымқыл матамен тазалауға болады. Суға немесе басқа сұйықтықтарға салмау керек.
- Шприц-қаламды түпнұсқалық қаптамасында қауіпсіз жерде сақтаңыз.
- Шприц-қаламда ерітінді таусылғанда, оны тастаңыз.
- Дозалау күнделігін жүргізу
- Емделу күнін, әр инъекция салу күнін және уақытын жазып қойыңыз.
- Тағайындалған дозаныңызды «Тағайындалған доза» бөліміне жазыңыз.
- Инъекция енгізер алдында Сіздің дұрыс дозаны енгізгеніңізді тексеріңіз.
- Инъекциядан кейін Өзіңіз енгізген дозаны жазып қойыңыз: толық доза енгізгеніңізді растаңыз немесе, егер ол «0»-ден өзгешеленсе, дозаны бақылау терезесінен көрінген санды жазыңыз.
- Қажет болса, «Инъекциядан кейін көрінетін сан» бағанында көрсетілген жетпей тұрған дозаны жинап, жаңа қалам көмегімен қайтадан инъекция жасаңыз.
- Осы жетпей тұрған дозаны «Енгізуге арналған доза» бөлімінде келесі бағанға жазып қойыңыз.
-
ХОРАПУР
ХОРАПУР
(хориондық гонадотропин)
(хориондық гонадотропин)
ҚРТ -
ЭНДОМЕТРИН
ЭНДОМЕТРИН
(прогестерон)
(прогестерон)
ҚРТ - Аппликаторды ашыңыз.
- Таблетканы аппликатордың ұшындағы арнайы орынға бекітіңіз, таблетка түсіп қалмауға тиіс.
- Тұрған, отырған немесе тізені бүгіп, шалқадан жатқан күйде таблеткасы бар аппликаторды қынапқа терең енгізіңіз.
- Таблетканы босатып шығару үшін аппликатор поршенін басыңыз. Аппликаторды қынаптан шығарып, оны жылы ағынды сумен мұқият жуып-шайыңыз, жұмсақ матамен құрғата кептіріп, келесі қолдануға алып қойыңыз.
ДЕКАПЕПТИЛ (трипторелин)
Қазақстан Республикасы
Денсаулық сақтау министрлігі Фармация комитеті Төрағасының
2018 жылғы «07» 08
№ N016363 бұйрығымен
БЕКІТІЛГЕН
Дәрілік затты медициналық қолдану жөніндегі нұсқаулық
ДЕКАПЕПТИЛ
Саудалық атауы
Декапептил
Халықаралық патенттелмеген атауы
Трипторелин
Дәрілік түрі
Инъекцияға арналған 0,1 мг/мл ерітінді
Құрамы
1 мл препараттың құрамында:
белсенді зат – 0,0956 мг трипторелин бос негізі
қосымша заттар: натрий хлориді, мұзды сірке қышқылы, инъекцияға арналған су.
Сипаттамасы
Мөлдір түссіз ерітінді.
Фармакотерапиялық тобы
Антинеопластикалық және иммуномодуляциялайтын препараттар. Эндокриндік ем. Гормондар және олардың туындылары. Гонадотропин-рилизинг гормоны аналогтары. Трипторелин
АТХ коды L02AE04
Фармакологиялық қасиеттері
Фармакокинетикасы
Декапептилді тері астына енгізгеннен кейін трипторелиннің жүйелік биожетімділігі 100%-ға жуықты құрайды. Трипторелиннің жартылай шығарылу кезеңі шамамен 3-5 сағатты құрайды, бұл трипторелиннің организмнен 24 сағат ішінде шығарылатындығын, және тиісінше, ол эмбриондар пайда болған сәтте қан айналымда болмайтынын айғақтайды. Өте қарапайым пептидтер мен амин қышқылдарын түзетін метаболизм негізінен бауырда және бүйректе жүреді. Трипторелин негізінен несеппен бірге шығарылады.
Клиникалық зерттеулер бауыр және бүйрек функциясының ауыр бұзылулары бар пациенттерде трипторелиннің жиналып қалу қаупі мардымсыз екендігін айғақтайды (мұндай пациенттерде жартылай шығарылу кезеңі шамамен 8 сағатты құрайды).
Фармакодинамикасы
Декапептил – трипторелин (Д-Трип-6-гонадорелин) – табиғи гонадотропин-рилизинг гормонының (ГнРГ) синтетикалық декапептидтік аналогы. Трипторелин табиғи ГнРГ қарағанда әсер ету ұзақтығының үлкендігімен сипатталады және гипофизарлы деңгейде екі сатылы әсер етеді. Бастапқыда лютеиндейтін гормон (ЛГ) және фолликуланы стимуляциялайтын гормон (ФСГ) концентрацияларының («кенеттен жоғарылау» әсері) күрт жоғарылауынан кейін, қандағы ЛГ және ФСГ концентрациясы ГнРГ гипофизарлы рецепторларының десенситизациясымен, әрі қарай гонадтар функциясының едәуір нашарлауымен байланысты төмендейді. Декапептил әсерінің нақты ұзақтығы анықталған жоқ, бірақ гипофиз функциясының тежелуі препаратты соңғы енгізуден кейін кем дегенде 6 күнге созылады. Декапептилді енгізуді тоқтатқаннан кейін қандағы ЛГ деңгейінің төмендейтінін күтуге болады, мұндайда ЛГ деңгейі шамамен 2 аптадан кейін бастапқы мәніне оралады.
Гипофиздің функциясын Декапептилдің жәрдемімен тежеу ЛГ деңгейін жоғарылатпауы, осылайша, мезгілінен бұрын болатын овуляцияға және (немесе) фолликулдардың лютеинизациясына жол бермеуі мүмкін. ГнРГ агонисінің жәрдемімен емдеу циклдерді тоқтату жиілігін төмендетуге және қосымша репродуктивтік технология (ҚРТ) циклдерінде жүктіліктің басталу жиілігін арттыруға мүмкіндік береді.
Қолданылуы
- қосымша репродуктивтік технология (ҚРТ) шегінде аналық безге бақыланатын асқын стимуляция жүргізілетін әйелдерде лютеиндейтін гормон (ЛГ) деңгейінің мезгілінен бұрын жоғарылауының алдын алуда
Қолдану тәсілі және дозалары
Декапептилмен емдеуді әйелдердің бедеулігін емдеу тәжірибесі бар дәрігердің бақылауымен бастаған жөн. Декапептил құрсақ қабырғасының төменгі бөлігіндегі тері астына тәулігіне бір рет енгізуге арналған. Алғашқы инъекциядан кейін инъекцияға қатысты болуы мүмкін аллергиялық/жалған-аллергиялық реакция симптомдарын анықтау үшін пациент 30 минут бойы бақылауда болуы керек. Мұндайда тиісті жағдайлар жасалуы және осындай реакцияны емдеуге арналған дәрілік заттармен қамтамасыз етілу қажет. Пациент жоғары сезімталдық реакцияларын айғақтауы мүмкін белгілер мен симптомдар жөнінде, осы реакциялардың зардаптары және дереу медициналық араласымның қажеттілігі жөнінде дәрігерден тиісті нұсқаулар алған жағдайда әрі қарайғы инъекцияларды өзі жасай алады. Липодистрофияның алдын алу үшін препаратты енгізетін жерді ұдайы алмастырып отырған жөн.
Қосымша репродуктивтік технология (ҚРТ) шегінде аналық бездерге бақыланатын асқын стимуляция жүргізілетін әйелдерде лютеиндейтін гормон (ЛГ) деңгейінің мезгілінен бұрын жоғарылауына жол бермеу
Емдеуді фолликулярлы фазаның басында (етеккір оралымының 2-ші немесе 3-ші күні) немесе лютеинді фазаның (етеккір оралымының 21–23-ші күндері немесе күтілген етеккірдің басталуынан 5-7 күн бұрын) ортасында бастауға болады. Аналық бездерге гонадотропиндермен бақыланатын асқын стимуляция жүргізуді Декапептилмен емдеуді бастағаннан кейін шамамен 2-4 аптадан соң бастаған жөн. Аналық бездер реакциясын тек қана аналық бездер УДЗ, немесе, дұрысы, эстрадиол концентрациясын өлшеумен үйлестірілген аналық бездер УДЗ қамтылатын әдістермен бақылап, қажет болса, гонадотропиндер дозасын ретке келтіру керек. Фолликулдардың тиісті мөлшері керекті өлшемге жеткеннен кейін, Декапептилмен және гонадотропиндермен емдеуді тоқтату және фолликулдардың ақырғы жетілуін индукциялау үшін адамның хориондық гонадотропині (аХГ) инъекциясын бір рет жасау керек. Егер 4 аптадан кейін әдістің тиімділігі айғақталмаса (бұл эндометрий ажырауының УДЗ-де айғақталуымен немесе, мүмкіндігінше УДЗ әдісін эстрадиол концентрациясын анықтаумен біріктіріп анықталады), Декапептилмен емдеуді тоқтату жөніндегі мәселені қарастырған жөн. Жалпы емдеу ұзақтығы әдетте 4 аптадан 7 аптаға дейінді құрайды. Декапептилді қолданған кезде лютеинді фазаның сақталуын емдеудің бекітілген сызбасына сай қамтамасыз еткен жөн.
Бүйрек немесе бауыр функциясы бұзылған пациенттерде дозаны түзетудің қажеті жоқ.
Жағымсыз әсерлері
Өте жиі (≥1/10)
- жыныстық құштарлықтың төмендеуі, ұйқының бұзылуы
- бас ауыру
- қан кернеулер
- гипергидроз
- вульвовагинальді құрғақтық, қынаптық қан кету
Жиі ( ≥1/100-ден - <1/10-ға дейін)
- гиперандрогенизм
- көңіл-күйдің құбылуы, көңіл-күйдің болмауы, үрейлену сезімі, ұйқысыздық, депрессия
- бас айналу, қажығыштық
- жүрек соғысының жиілеуі
- жоғарғы тыныс алу жолдарының инфекциялары, тұмауға ұқсас аурулар
- жүректің айнуы, диспепсия, іштің желденуі, іштің ауыруы
- таздану
- буындардың ауыруы
- астения, шаршағыштық, тітіркенгіштік
- дене салмағының артуы
- диспареуния, сүт безінің ауруы, тоқтату салдарынан қан кету
Жиі емес ( ≥1/1000-нан - <1/100-ге дейін)
- парестезиялар
- вестибулярлы бас айналу
- арқаның ауыруы, сүйектің ауыруы, бұлшықет түйілулері
- инъекция жасалған жердің ісінуі, ауыруы, қызаруы
- артериялық қысымның жоғарылауы
- аналық бездердің асқын стимуляциялану синдромы, аналық бездердің кистасы
Сирек ( ≥1/10000-нан - <1/1000-ға дейін)
- құсу
- бұлшықеттің ауыруы
- жамбастың ауыруы, меноррагия
Белгісіз
- асқын сезімталдық, анафилаксиялық реакция
- сананың шатасуы
- көрудің нашарлауы, көрудің көмескіленуі
- диспноэ
- абдоминальді жайсыздық, диарея
- ангионевроздық ісіну, қышыну, бөртпе, есекжем
- бұлшықет әлсіздігі
- дисменорея, метроррагия, сүт бездерінің ауыруы, аменорея
- дене температурасының жоғарылауы, дімкәстік
- инъекция жасалған жердің қабынуы
Қолдануға болмайтын жағдайлар
- трипторелинге немесе препараттың басқа да компоненттеріне жоғары сезімталдық
- гонадотропин-рилизинг гормонына (ГнРГ) немесе кез келген басқа ГнРГ аналогіне жоғары сезімталдық
- жүктілік және лактация кезеңі
- остеопороз
- аналық бездердің поликистозы
- 18 жасқа дейінгі балалар
Дәрілермен өзара әрекеттесуі
Трипторелинді гонадотроптық гормондардың гипофизарлы секрециясына ықпалын тигізетін препараттармен бірге қолданғанда өте сақ болу қажет, мұндайда пациенттің гормональді жағдайын қадағалап отыру керек.
Гистаминді босатып шығаратын препараттарды қоса есептегенде, әдетте пайдаланылатын дәрілік препараттармен өзара әрекеттесуі мүмкін екендігін жоққа шығаруға болмайды.
Айрықша нұсқаулар
ГнРГ агонистерін қолдану сүйектердің минералдық тығыздығын төмендетуі мүмкін. Остеопороздың пайда болу қаупінің қосымша факторлары (мысалы, алкогольді созылмалы шамадан тыс қабылдау, темекі тарту, сүйектің минералдық тығыздығын төмендететін, мысалы, құрысуға қарсы дәрілер немесе кортикостероидтар сияқты препараттармен ұзақ емдеу, отбасылық анамнезінде остеопороздың болуы, дұрыс тамақтанбау, жүйке анорексиясы) бар пациенттерді емдеу үшін препаратты аса сақтықпен қолданған жөн.
Осы сәттегі қолда бар деректер бойынша, емдеуді тоқтатқаннан кейін әйелдердің көбісінде сүйек салмағы қалпына келеді.
Остеопороздың пайда болуының қосымша факторлары бар пациенттерде сүйектердің минералды тығыздығы азаюы, өте қауіпті болуы мүмкін болғандықтан, трипторелинмен емдеу жөнінде шешімді әрбір жекелеген жағдайларда таразылап қабылдаған және емдеуді жан-жақты баға беру нәтижелері, яғни емдеу пайдасы қаупінен басым екендігі анықталған кезде ғана бастаған жөн. Мұндайда сүйектердің минералды тығыздығының төмендеуіне қарсы әсер ететін қосымша шараларды қолдану керек.
Сирек жағдайларда ГнРГ агонистерімен емдеу бұрын анықталмаған гипофиздің гонадотропты аденомасының бар екендігін анықтауы мүмкін. Мұндай науқастарда кенеттен туындайтын бас ауырумен, құсумен, көрудің нашарлауымен және офтальмоплегиямен сипатталатын гипофизарлы апоплексия пайда болуы мүмкін.
ГнРГ агонистерімен, мысалы, трипторелин сияқты, ем қабылдап жүрген пациенттерде депрессивтік жағдайдың пайда болу қаупінің жоғарылағаны байқалады. Пациенттерді бұдан хабардар ету және тиісті симптомдар пайда болған жағдайда қажетті ем тағайындау керек.
Аналық бездердің стимуляциясын жан-жақты медициналық бақылау жүргізу арқылы жүзеге асыру қажет.
Бүйрек немесе бауыр функциясы бұзылған пациенттерде трипторелиннің жартылай шығарылуының ақырғы кезеңі, дені сау пациенттердегі 3-5 сағатпен салыстырғанда, 7-8 сағатты құрайды. Әсерінің осындай өте ұзаққа созылуына қарамастан, трипторелин қан айналуынан эмбрион пайда болған сәтке дейін-ақ шығарылады деп күтіледі.
Белсенді аллергиялық жағдайдың белгілері және симптомдары бар немесе анамнезінен алллергиялық реакцияларға бейімділігі бар екендігі белгілі болған әйелдерді емдеу үшін препаратты аса сақтықпен қолданған жөн. Анамнездегі аллергиялық жағдайы ауыр әйелдерді емдеу үшін Декапептилді қолданбау керек. Бала көтере алатын жастағы әйелдерге ем жүргізуді бастамас бұрын, жүктіліктің бар-жоқтығын анықтау үшін, оларды мұқият тексеруден өткізу қажет.
ҚРТ қолдану көп ұрықты жүктіліктің пайда болу, жүктілік кезінде ұрықтың өлуі, жатырдан тыс жүктілік және іштен туа болатын даму кемістіктері қаупінің жоғарылауымен байланысты. Бұл қауіптер аналық бездерді бақыланатын асқын стимуляциялауда Декапептилді қосымша ем ретінде қолданған жағдайда сақталады. Аналық бездерге бақыланатын асқын стимуляция кезінде Декапептилді қолдану аналық бездердің асқын стимуляциялану синдромының (ААСС) және аналық бездер кистасының пайда болу қаупін арттыруы мүмкін.
ГнРГ аналогтарын және гонадотропиндерді қолданудан фолликулдардың стимуляциялануы, бұған бейім пациенттердің аздаған бөлігінде, әсіресе поликистозды аналық бездер синдромы бар болғанда, елеулі түрде күшейетінін байқауға болады.
Трипторелинді гонадотропиндермен бірге қолданумен байланысты, ГнРГ басқа аналогтарындағыға ұқсас, аналық бездердің асқын стимуляциясының (ААС) пайда болу жағдайлары жөнінде мәлімделді.
Аналық бездердің асқын стимуляциясы синдромы (ААСС)
ААСС аналық бездер өлшемінің едәуір ұлғаюын, қан сарысуында жыныс стероидтары дейгейінің жоғарылауын, сондай-ақ қантамырлар өткізгіштігінің жоғарылауын қамтиды, бұл құрсақ, плевралық және, сирек жағдайларда перикардиальді қуыстарда сұйықтықтардың жиналуына әкеп соғуы мүмкін.
ААСС ауыр жағдайларында келесі симптоматика байқалуы мүмкін: абдоминальді ауыру, іштің кебуі, аналық бездер өлшемінің едәуір ұлғаюы, дене салмағының артуы, диспноэ, олигурия және жүректің айнуын, құсуды және диареяны қоса асқазан-ішектік біліністер. Клиникалық тексерулерде гиповолемия, қанның қоюлануы, электролиттер теңгерімінің бұзылуы, асцит, гемоперитонеум, плевралық жалқық, гидроторакс, жедел өкпелік дистресс-синдромы және тромбоэмболиялық құбылыстар байқалуы мүмкін.
Гонадотропиндермен емдеуге аналық бездердің шамадан тыс реакциясы, овуляцияның стимуляциясы үшін адамның хориондық гонадотропинін (аХГ) қолданған кездегі жағдайдан басқасында, ААСС пайда болуын сирек туындатады. Тиісінше, ААСС пайда болған жағдайларда аХГ енгізуді тоқтатқан және пациентге жыныстық қатынасты қоя тұруға немесе кем дегенде 4 күн бойы контрацепцияның бөгеттік әдістерін пайдалануға кеңес берген жөн. ААСС тез өршуі (24 сағаттан бастап бірнеше күнге дейін) және ауыр медициналық асқыну болуы мүмкін; тиісінше, пациенттің жағдайын аХГ енгізгеннен кейін кем дегенде екі апта қадағалаған жөн.
Жүктілік басталған жағдайда ААСС өте ауыр және өте ұзаққа созылатын түрде болуы мүмкін. ААСС көбіне гормональді ем жүргізуді тоқтатқаннан кейін байқалады және ең жоғары ауырлыққа шамамен 7-10 күн емдегеннен кейін жетеді. Әдетте ААСС етеккір басталысымен өздігінен жоғалады.
Егер ауыр түрдегі ААСС байқалса, гонадотропиндермен емдеуді тоқтату қажет (егер оны қолдану әлі де жалғасқан болса), пациентті ауруханаға жатқызып, тыныштық, электролиттер немесе коллоидтар және гепарин ерітінділерін вена ішіне енгізуді қамтитын арнайы ААСС емін бастаған жөн.
Бұл синдром поликистозды аналық бездер синдромдары бар пациенттерде жиі байқалады. ААСС пайда болу қаупі, гонадотропиндердің өзін ғана қолданғанмен салыстырғанда, ГнРГ агонистерін гонадотропиндермен бірге қолданған жағдайда жоғары болуы мүмкін.
Аналық бездердің кисталары
ГнРГ агонистерімен емдеудің бастапқы сатысында аналық бездердің кистасы түзілуі мүмкін. Әдетте олар симптомсыз және ешқандай қызмет атқармайды.
Жатыр миомасы және эндометриоз
Емделу кезінде әрі қарай жатырдан қан кету болмауы тиіс (алғашқы айдан басқасында), керісінше жағдайда қан плазмасындағы эстроген деңгейін тексеру қажет. Егер бұл деңгей 50 пг/мл-ден төмен болса, органикалық зақымдануларды іздеп тапқан жөн. Емдеуді тоқтатқаннан кейін аналық бездердің функциясы қалпына келеді, етеккірлік қан кету соңғы инъекциядан кейін 7-12 аптадан соң қайта басталады.
Емдеудің алғашқы аптасы ішінде гормональді емес контрацептивтерді пайдаланған жөн, өйткені гонадотропиндердің алғашқы секрециясы овуляцияны стимуляциялауы мүмкін. Сондай-ақ оларды соңғы инъекциядан кейінгі 4-ші аптадан бастап етеккірдің қалпына келуіне дейін немесе контрацепцияның жаңа әдісін тағайындағанға дейін пайдаланған жөн.
Жатыр миомасын емдеу кезінде жатыр мен миоама өлшемін жүйелі түрде анықтап отыру қажет. Миома тіндерінің кішіреюмен салыстырғанда, жатыр өлшемінің пропорционалды емес тез кішіреюі жекелеген жағдайларда қан кетуге және сепсиске әкеп соқты.
Жүктілік және лактация кезеңі
Бала көтере алатын жастағы әйелдер емделмес бұрын, жүктіліктің бар-жоқтығын анықтау үшін, мұқият тексерілуден өтуі тиіс.
Жүктілік кезінде трипторелинді қолдану жөнінде деректердің шектеулі болуы іштен туа болатын кемістіктердің пайда болу қаупінің жоғары екендігін айғақтамайды. Дегенмен, ұзаққа созылған проспективті зерттеулер саны тым шектеулі. Жануарларға жасалған зерттеу деректері жүктілік барысына немесе босанғаннан кейін ұрықтың дамуына тікелей немесе жанама зиянды әсерін көрсетпейді, бірақ фетоуыттылық және босанудың кідіруі жөнінде деректер бар. Фармакологиялық әсері жөніндегі деректерге сай, жүктілікке және ұрыққа жағымсыз әсерін жоққа шығаруға болмайды, сондықтан Декапептилді жүктілік кезінде қолдануға кеңес берілмейді.
Бала көтере алатын жастағы әйелдер препаратпен емделу кезінде және етеккірі қалпына келгенге дейін контрацепцияның гормональді емес әдістерін пайдалануы керек.
Трипторелиннің емшек сүтіне бөлініп шығатыны-шықпайтыны белгісіз. Емшек еметін балаларда трипторелинге жағымсыз реакциялардың бар болуына байланысты, препаратты қолдануды бастағанға дейін және қолдану кезінде емшек емізуді тоқтату керек.
Дәрілік заттың көлік құралын немесе қауіпті механизмдерді басқару қабілетіне ықпал ету ерекшеліктері
Препараттың жағымсыз әсерлерін ескеріп, көлік құралын немесе қауіпті механизмдерді басқарған кезде сақ болған жөн.
Артық дозалануы
Симптомдары: артық дозалану препаратты ұзақ уақыт қолданудан туындауы мүмкін. Артық дозалану салдарынан қандай да болсын жағымсыз әсерлер жөнінде мәлімделген жоқ.
Емі: Декапептилмен емдеуді уақытша тоқтата тұрған жөн.
Шығарылу түрі және қаптамасы
1 мл препараттан қорғағыш қалпақшамен жабдықталған, инелері бар шыны шприц-ампулаларда.
7 шприц -ампуладан ұяшықты пластик қаптамаға салынған.
1 ұяшықты қаптамадан медициналық қолдану жөніндегі мемлекеттік және орыс тіліндегі нұсқаулықпен бірге картон қаптамаға салынған.
Сақтау шарттары
Құрғақ жерде, 2оС-ден 8°С-ге дейінгі температурада сақтау керек.
Балалардың қолы жетпейтін жерде сақтау керек!
Сақтау мерзімі
3 жыл
Қаптамасында көрсетілген жарамдылық мерзімі өткеннен кейін қолдануға болмайды.
Дәріханалардан босатылу шарттары
Рецепт арқылы
Өндіруші
Ферринг ГмбХ, Германия
Wittland 11, 24109 Kiel,Germany
Тіркеу куәлігінің ұстаушысы
Ферринг ГмбХ, Германия
Қазақстан Республикасы аумағында тұтынушылардан дәрілік заттың сапасына қатысты шағымдарды (ұсыныстарды) қабылдайтын және дәрілік заттың тіркеуден кейінгі қауіпсіздігін қадағалауға жауапты ұйымның атауы, мекенжайы және байланыс деректері:
«Ферринг Фармацевтикалс СА» Қазақстан Республикасындағы өкілдігі
Қазақстан Республикасы
050022, Алматы қ., Наурызбай батыр к-сі, 99/1 үй, 41Б кеңсе
Тел.\факс: (727) 311-54–47
МЕНОГОН (менотропин)
Қазақстан Республикасы
Денсаулық сақтау министрлігі
Фармация комитеті Төрағасының
2017 жылғы “26” 06
№ N009053 бұйрығымен
БЕКІТІЛГЕН
Дәрілік затты медициналық қолдану жөніндегі нұсқаулық
МЕНОГОН
Саудалық атауы
Меногон
Халықаралық патенттелмеген атауы
Жоқ
Дәрілік түрі
Инъекция үшін ерітінді дайындауға арналған лиофилизацияланған ұнтақ
75 ХБ ФСГ және 75 ХБ ЛГ еріткішпен жиынтықта
Құрамы
белсенді зат - менотропин (75 ХБ фолликулостимуляциялайтын гормон және 75 ХБ лютеинизирлеуші гормон)
қосымша заттар: лактоза моногидраты, натрий гидроксиді, инъекцияға арналған су
Еріткіш:натрий хлориді, хлорсутек қышқылы 10%, инъекцияға арналған су
Сипаттамасы
Иісі жоқ, корж түріндегі ақ лиофилизацияланған ұнтақ.
Еріткіш – мөлдір түссіз ерітінді
Фармакотерапиялық тобы
Жыныс гормондары және жыныс жүйесі модуляторлары. Гонадотропиндер және басқа овуляция стимуляторлары. Менопаузалық гонадотропин.
АТХ коды G03GA02
Фармакологиялық қасиеттері
Фармакокинетикасы
Фолликулостимуляциялайтын гормон (ФСГ) қан плазмасында ең жоғары деңгейге препаратты бұлшықет ішіне енгізгеннен кейін 6-48 сағаттан соң және тері астына енгізгеннен кейін 6-36 сағаттан соң жетеді. Осыдан кейін қандағы ФСГ концентрациясы біртіндеп төмендейді. Гонадотропиндердің жартылай шығарылу кезеңі препаратты бұлшықет ішіне енгізгеннен кейін 56 сағатты және тері астына енгізгеннен кейін 51 сағатты құрайды.
Меногонның биожетімділігі, бұлшықет ішіне енгізгеннен кейінгіге қарағанда, тері астына енгізгеннен кейін жоғары болады. Бұлшықет ішіне енгізгеннен кейін алынған ФСГ мәні мынаны құрайды: AUC0- = 320,1 млБ/мл х сағат, Cmax = 4,15 млБ/мл, tmax= 18 сағат; тері астына енгізгеннен кейін - AUC0- = 385,2 млБ/мл х сағат, Cmax = 5,62 млБ/мл, tmax = 12 сағат.
Адамның менопаузалық гонадотропині көбіне бүйректер арқылы шығарылады.
Фармакодинамикасы
Меногон адамның менопаузалық гонадотропин препараты болып табылады. Препаратта 75 ХБ фолликуланостимуляциялайтын (ФСГ) және 75 ХБ лютеиндейтін гормон (ЛГ) бар, олар адам гипофизімен өндіріледі. Әсер етуші затты менопауза кезеңіндегі әйелдің несебінен алады.
Меногон әйелдерде қандағы эстрогендер деңгейін, өсуді және анабездердің фолликулаларының пісіп-жетілуін арттырады.
Меногон еркектерде Сертолидің атабездердегі жетілмеген жасушалардың жетілген жасушаларға өзгеруін демейді. Көбінесе атабез өзекшелерінің өсіп-жетілуіне және сперматозоидтардың дамуына ықпалын тигізеді. Алайда, ол үшін андрогендердің тестикулаішілік жоғары концентрациясы болуы қажет, ол үшін адамның хориондық гонадотропинін (АХГ) қолдана отырып, алдын ала ем жүргізуді қажет етеді.
Қолданылуы
Меногон келесі клиникалық жағдайларда бедеулікті емдеу үшін қолданылады:
Әйелдерде
- кломифен цитратымен емдеуге жауап болмаған әйелдердегі ановуляцияда (атап айтқанда, аналық бездердің овариальді поликистозы нәтижесіндегі).
- қосымша ұрпақ өрбіту технологиясын (ҚҰӨТ) жүргізген кезде фолликулалардың көптеп өсуін демеу мақсатында анабездердің бақыланатын гиперстимуляциясында (in vitro ұрықтандыру/эмбриональді тасымалдану, гаметаның жатырішілік тасымалдау (ГЖІТ) және сперматозоидтарды плазма ішілік инъекциялау (СИПИ)
Ерлерде
- гипогонадотропты гипогонадизмнен туындаған сперматогенез жеткіліксіздігінде
Қолдану тәсілдері және дозалары
Меногон препаратымен емдеу дәрігердің бақылауымен жүзеге асырылуы тиіс.
Препаратты қоса берілген еріткіште еріткеннен кейін тері астына немесе бұлшықет ішіне енгізеді. Препарат сұйылтылғаннан кейін бірден пайдаланылуы тиіс. Сілкімеу керек. Егер ішінде бөлшектер бар болса немесе мөлдір емес болса, ерітіндіні қолданбау керек. Аналық бездердің экзогендік гонадотропиндерге жекелей реакциясы елеулі дәрежеде ауытқып тұрады, бұл дозалаудың стандартталған сызбаларын қолдануға мүмкіндік бермейді. Осыған қарамастан, дозалары аналық бездердің емдеуге реакциясына байланысты жекелей таңдалады. Меногонды монотерапия түрінде де қолдануға немесе гонадотропин-рилизинг-гормон (ГНРГ) агонистерімен немесе антагонистерімен бірге енгізуге де болады. Ұсынылатын дозалары мен емдеудің ұзақтығы сәйкесінше емдеу хаттамасына тәуелді.
Әрбір жекелеген жағдайдағы емдеу ұзақтығы пациент әйелдің жеке ерекшеліктеріне (эстрадиол деңгейі және ультрадыбыстық зерттеу мәліметтері) байланысты.
Ановуляциядан (атап айтқанда анабездердің овариальды поликистозы нәтижесінде).
Меногонды қолдану арқылы емдеу мақсаты созылмалы адамның гонадотропины (САГ) енгізгеннен кейін шығатын ооцит бір граафова фолликуланы алу болып табылады.
Меногонды қолдануды етеккір оралымының алғашқы 7 күні ішінде бастаған жөн. Гипогонадотропты гипогонадизмі бар кейбір пациент әйелдерде етеккір болмайды және эндогенді эстрадиолдың төмен деңгейі бақыланады, сондықтан емді кез келген уақытта бастауға болады. Ұсынылатын бастапқы дозасы 7 күн бойы күніне 75-150 ХБ құрайды. Кейінгі дозалауды клиникалық бақылауларына (анабездерді ультрадыбыстық зерттеу және/немесе эстрадиол деңгейін бақылау) негіздей отырып, әр адамға жекелей белгілеу қажет. Дозаны 7 күнде бір реттен жиі емес реттеп отыруға болады. Дозаны тиісті бер реттік арттыру 37,5 ХБ құрайды және 75 ХБ-дан аспауға тиіс. Препараттың ең жоғары тәуліктік дозасы 225 ХБ-дан аспауға тиіс. 4 апта бойы нәтиже жоқ болған жағдайда емдеу курсын тоқтатқан және жаңа курсты өте жоғары дозада бастаған жөн.
Қолайлы нәтижеге қол жеткізгеннен кейін Меногонның соңғы енгізілген дозасынан кейін келесі күні хорионды гонадотропты гормонның (ХГГ) 5000-нан 10000 ХБ-ға дейінгі бір реттік дозасын енгізу керек. ХГГ енгізген күні және келесі күні жыныстық қатынасты жасауға болады. Баламалы тәсілі жатырішілік жасанды ұрықтандыруды жүзеге асыру болып табылады.
Егер Меногонды қолдануға шамадан тыс реакция байқалса, емдеу курсын тоқтату және ХГГ енгізбеу қажет. Емделуші әйел гормональді емес контрацептивтерді қолдануға немесе келесі етеккірлік қан кету басталғанша жыныстық қатынасты тоқтата тұруға тиіс.
Қосымша ұрпақ өрбіту технологиясын жүргізген кезде фолликулалардың көптеп өсуін демеу мақсатында анабездердің бақыланатын гиперстимуляциясында, in vitro ұрықтандыру
Гонадотропин рилизинг-фактор агонистерімен емдеу курсынан өткен пациенттерді Меногонмен емдеуді агониспен емдеуді бастағаннан кейін шамамен 2 аптадан соң бастаған жөн.
Меногонның тиісті бастапқы дозасы емдеудің кем дегенде алғашқы 5 күні бойы 150-225 ХБ құрайды. Клиникалық бақылауларға негіздей отырып (ультрадыбыстық зерттеу және/немесе эстрадиол деңгейін бақылау), келесі дозалау әр адамға жекелей болуға тиіс, бірақ 150 ХБ-дан аспауға тиіс, ең жоғары тәуліктік доза – 450 ХБ. Емдеу ұзақтығы 20 күннен аспауы тиіс.
Төмендетілген реттелімді қарастырмайтын үлгілерде Меногонмен емдеуді етеккір оралымының 2-3 күні бастаған жөн. Ұсынылған дозасы мен дозалау режимі ХГГ агонистерімен төмендетілген реттелімнің жоғарыда аталған хаттамасында көрсетілгендей.
Фолликулалардың қажетті мөлшеріне сәйкесінше өлшемге жеткен кезде, пациент әйелдерге фолликуланың түпкілікті өсіп-жетілуін индукциялау және ооцитті шығаруға дайындау үшін ХГГ-нің 10000 ХБ-ға дейінгі бір реттік дозасы енгізіледі. Пациент әйелдер ХГГ-ні енгізгеннен кейін 2 апта бойы мұқият бақылауда болуы тиіс.
Егер Меногонды қолдануға шамадан тыс реакция байқалса, емдеу курсын тоқтату және ХГГ енгізбеу қажет. Пациент әйелдер гормональді емес контрацептивтерді қолдануы немесе келесі етеккірлік қан кету басталғанша жыныстық қатынасты тоқтата тұруы тиіс.
Гипогонадотропты гипогонадизмнен туындаған сперматогенез жеткіліксіздігі
Тиісті ХГГ дозасын (мысалы, 1500-ден 5000 ХБ-ға дейін - аптасына 3 рет) 4 - 6 ай бойы енгізгеннен кейін тестостерондар деңгейі қалыпқа келген кезде Меногонды аптасына 3 рет 75-тен 150 ХБ-ға дейінгі дозада аптасына 3 рет тиісті 1500 ХБ доза ХГГ-мен біріктіріп енгізген жөн. Біріктіріп емдеу сперматогенез жақсара бастағанға дейін кем дегенде 3-4 айға созылуы тиіс. Егер осы кезең ішінде пациентте реакция байқалмаса, онда біріктірілген емді сперматогенезге қол жеткенше әрі қарай жүргізу қажет. Қазіргі клиникалық деректер сперматогенезге қол жеткізу үшін 18 айлық емдеу курсы қажет екенін көрсетеді.
Жағымсыз әсерлері
Әйелдер
Клиникалық зерттеулерде хабарланған Меногонмен емдеу кезіндегі анағұрлым жиі жағымсыз реакциялар аналық бездердің гиперстимуляциясы синдромы (АГС) және енгізген жердегі реакциялар болып табылды. Төмендегі кестеде Меногонмен ем қабылдап жүрген пациенттердегі негізгі жағымсыз реакциялар келтірілген, реакциялар жүйе-ағза кластары (ЖАК) бойынша жіктелген.
|
Жүйе-ағза класы |
Өте жиі |
Жиі |
Жиі емес |
Өте сирек |
|
Иммундық жүйе тарапынан болатын бұзылулар |
|
|
|
Жоғары сезімталдық |
|
Жүйке жүйесі тарапынан болатын бұзылулар |
|
Бас ауыруы |
|
|
|
Асқазан-ішек жолы тарапынан болатын бұзылулар |
|
Жүрек айнуы, іштің ауыруы, құсу |
|
|
|
Тері мен теріасты тіндері тарапынан болатын бұзылулар |
|
Бөртпе |
|
|
|
Жыныс мүшелері мен сүт бездері тарапынан болатын бұзылулар |
|
Жеңіл, орташа және ауыр АГС |
|
|
|
Жалпы бұзылулар және инъекция орнындағы реакциялар |
* Инъекция орнындағы реакциялар және ауыру |
Тұмаутәрізді симптомдар |
Қызба |
|
* Инъекция орнындағы реакциялар жергілікті көтерімділігіне жүргізілген клиникалық зерттеулерге қатысқан пациенттердің 55 - 60%-ында байқалды. Шамамен 12% жағдайда реакцииялар ауыр түрі ретінде бағаланды. Көпшілік жағдайларда мұндай реакциялар тері астына енгізгеннен кейін байқалған. Бұлшықет ішіне енгізгеннен кейін, инъекция орнындағы реакциялар зерттеулерге қатысқан пациенттердің 13%-ында байқалды.
Анафилаксия реакцияларының бірлі-жарым жағдайлары туралы хабарланды.
АГС жағдайларында гонадотропиндерді енгізумен байланысты тромбоэмболиялық асқынулардың бірлі-жарым жағдайлары мен аналық бездердің бұратылуы туралы хабарланды.
Ерлер
Гонадотропиндердің көмегімен емдеуге байланысты гинекомастия, акне және дене салмағы артқан жағдайлар туралы хабарланды. Ерлерде енгізген жердегі реакциялар мен жоғары сезімталдық болуы мүмкін.
Қолдануға болмайтын жағдайлар
- препараттың кез келген компонентіне аса жоғары сезімталдық
- балаларға және 18 жасқа дейінгі жасөспірімдерге
Әйелдерде
- гипофиз немесе гипоталамус ісігі
- жүктілік және лактация кезеңі
- кисталар немесе аналық бездің ұлғаюы, олар овариальді поликистоз нәтижесі болып табылмайды
- шығу тегі анықталмаған гинекологиялық қан кетулер
- аналық без, жатыр немесе сүт безі карциномасы
Ерлерде
- гипофиз немесе гипоталамус ісігі
- простата карциномасы
- аталық без ісігі
Төменде сипатталған жағдайларда Меногонмен емдеу жағымды нәтиже бермейді:
- аналық бездердің бастапқы жайсыздығы
- жыныс мүшелерінің жүктілікпен үйлеспейтін аномалиясы
- жатырдың жүктілікпен үйлеспейтін фиброзды жаңа түзілімдері
- аталық бездердің бастапқы жеткіліксіздігі (ерлерде)
Дәрілермен өзара әрекеттесуі
Басқа дәрілік заттармен араластырмау керек.
Клиникалық тәжірибенің жоқтығына қарамастан, Меногон мен кломифен цитратын бір мезгілде қолдану фолликулярлы пісіп-жетілу реакциясын күшейтуі мүмкін деп шамаланады. Меногонды гонадотропты рилизинг фактор агонистерімен біріктіріп қолданған кезде гипофизарлы десенсибилизация мақсатында анабез тарапынан жағымды реакцияға қол жеткізу үшін өте жоғары дозалар керек болуы мүмкін.
Айрықша нұсқаулар
Меногон күшті әсері бар, ауырлық дәрежесі әр түрлі жағымсыз әсерлерді туғызуға қабілетті гонадотроптық препарат. Сондықтан препаратты тек бедеулікті емдеу әдістерін жақсы меңгерген дәрігердің қадағалауымен ғана қолдану керек. Гонадотропиндердің көмегімен емдеу дәрігерлердің белгілі бір уақытын алады және аналық бездердің ультрадыбыстық зерттеу кірістірілген, дұрысы қан плазмасындағы эстрадиол деңгейін бақылай отырып емдеуге реакциясын мұқият, жүйелі бақылауды қажет етеді. Менотропинді енгізуге реакция пациенттерде әр түрлі, сонымен қатар олардың кейбірі – өте төмен болуы мүмкін. Емдеудің мақсаттарына қол жеткізу үшін препараттың емдеу мақсатына сәйкес келетін ең төменгі тиімді дозасын қолдану керек.
Емдеуді бастамастан бұрын екі жұптастардың да белсіздігі себебін зерттеу, сондай-ақ мүмкін болатын қарсы көрсетілімінің бар екендігіне медициналық тексеру жүргізу қажет. Атап айтқанда, пациент әйелдерде гипотиреоидизмнің, гиперпролактинемияның адренокортикальді жеткіліксіздігінің, гипофизарлы немесе гипоталамиялық ісіктің бар-жоқтығын тексеру қажет, осы патологиялық жағдайда қарастырылған тиісті емді тағайындау қажет. Әйелдерде бедеулікті емдеуді бастар алдында анабездерінің қызмет жағдайына (ультрадыбыстық диагностика және қандағы эстрадиол деңгейіне) баға берген жөн. Меногонның алғашқы инъекциясы дәрігердің мұқият бақылауымен жүргізілуге тиіс. Фолликулалардың өсуі ынталандырылған пациенттерде анабездер өлшемінің ұлғайғаны байқалуы немесе анабездердің гиперстимуляциясы синдромының дамуы мүмкін. Меногонның тиісті дозалау тәртібін орындау және анабездердің реакциясына мұқият бақылау жасау осы жағымсыз әсерлердің даму қаупін барынша азайтуға жәрдемдеседі. Фолликулалардың жетілуіне шұғыл баға беру дәрігерден мұндай тестілерді интерпретациялауда сәйкесінше тәжірибесінің болуын талап етеді.
Аналық бездердің гиперстимуляциясы синдромы (АГС)
АГС аналық бездердің асқынусыз ұлғаюынан өзгешеленеді. АГС синдром болып табылады, оның симптомдарының ауырлығы арта түсуі мүмкін. Оның белгілеріне аналық бездердің ұлғаюы, жыныстық гормондар деңгейінінің жоғарылығы және қантамырлар өткізгіштігінің жоғарылауы кіреді, бұл перитонеальді, плевралық, жекелеген жағдайларда, перикард қуыстарында сұйықтықтың жинақталуына алып келуі мүмкін.
АГС ауыр жағдайларында мынадай симптомдар байқалуы мүмкін: іштің ауыруы, іштің кебуі, аналық бездердің шамадан тыс ұлғаюы, дене салмағының артуы, ентігу, олигурия және жүрек айнуы, құсу және диарея сияқты асқазан-ішек симптомдары. Клиникалық тексеру кезінде гиповолемия, қанның қоюлануы, электролиттік теңгерімнің бұзылуы, асцит, гемоперитонеум, плевралық жалқық, гидроторакс, өкпенің жедел дистресс-синдромы және тромбоэмболия анықталуы мүмкін.
Гонадотропиндермен емдеуге шамадан тыс овариальді реакция овуляцияны стимуляциялау үшін АХГ қолданылған жағдайларды қоспағанда, сирек жағдайларда АГС дамуына алып келеді. Сондықтан овариальді гиперстимуляция кезінде АХГ көмегімен стимуляциялауды қолданудан бас тарта тұру және пациент әйелге кемінде 4 күн бойы жыныстық қатынастан бас тарту немесе контрацепцияның бөгеттік әдістерін пайдалануға кеңес беру керек. АГС өте жылдам үдеуі (24 сағаттан бірнеше күнге дейін) және күрделі симптоматикаға ие болуы мүмкін. Сондықтан, пациент әйел АХГ енгізгеннен кейін 2 апта бойы дәрігердің бақылауында болуы тиіс.
Аналық бездердің гиперстимуляциясы мен көпұрықты жүктіліктердің даму қаупін, препараттың ұсынылған дозалары мен енгізу режимін сақтай отырып, сондай-ақ емдеу курсын бақылай отырып төмендетуге болады. ВРТ жүргізген кезде гиперстимуляцияның даму қаупін овуляция алдында барлық фолликулаларды аспирациялау жолымен төмендетуге болады.
АГС ауыр формаларға енуі және жүктілік басталған жағдайда ұзағырақ болуы мүмкін. Көбінесе АГС гормональді емнен кейін дамиды және ең жоғарғы жиілігіне емдеу аяқталғаннан кейін шамамен 7-10 күннен соң жетеді. Әдетте АГС етеккір басталған кезде өздігінен басылады.
Ауыр АГС жағдайында гонадотропиндермен емдеуді тоқтатып (егер бұдан бұрын тоқтатылмаса), пациент әйелді ауруханаға жатқызу және АГС спецификалық емін бастау керек.
АГС көбінесе поликистозды аналық бездер (ПАС) синдромы бар әйелдерде кездеседі.
Көпұрықты жүктілік
Көпұрықты жүктіліктер, әсіресе ұрық саны көп болған кезде, ана мен бала үшін асқынулар қаупін арттырады.
Гонадотроптық гормонмен емдеудің нәтижесінде басталатын пациент әйелдерде, табиғи ұрықтану нәтижесіндегі жүктілікпен салыстырмалы түрде, көпұрықты жүктілік жағдайлары жиілейді. Көпұрықты жүктілік қаупін төмендету үшін, пациент әйелдердің аналық бездерінің реакцияларына мұқият қадағалау жүргізу қажет. ҚҰӨТ емшаралары жүргізілетін пациент әйелдерде көпұрықты жүктілік қаупі негізінен салынған эмбриондар санына, олардың сапасына және пациент әйелдің жас шамасына байланысты болып келеді.
Емдеу басталғанға дейін пациент әйелге көпұрықты жүктіліктің әлеуетті қаупі туралы хабарлап айту керек.
Мерзімінен бұрын босану
Фолликулалардың пісіп-жетілуіне ынталандыру жасалған әйелдерде немесе, табиғи ұрықтану жағдайына қарағанда, қосымша ұрпақ өрбіту технологиялары бағдарламасын жүргізген кезде мерзімінен бұрын босану жағдайлары жоғары болады.
Жатырдан тыс жүктілік
Жатыр түтіктерінің аурулары бар әйелдерде табиғи ұрықтану жағдайларына немесе бедеулікті емдеу салдарларына қарағанда, жатырдан тыс жүктіліктің даму қаупінің жоғарылығы байқалады. Қосымша ұрпақ өрбіту технологиясын (ҚҰӨТ) жүргізгеннен кейін жатырдан тыс жүктілік жағдайларының жиілігі, табиғи ұрықтану кезіндегі 1-1,5% жағдайларымен салыстырғанда, 2-5 % құрайтыны айтылған.
Ұрпақ өрбіту ағзаларының жаңа түзілімі
Бедеулікке байланысты бірнеше рет дәрі-дәрмектік ем қабылдаған әйелдерде анабездерде және басқа ағзаларда қатерсіз, сонымен қатар қатерлі жаңа түзілімдердің дамығаны байқалды, гонадотропинді қолдана отырып емдеу мен жаңа түзілімге бейімділіктің арасындағы байланыс анықталған жоқ.
Іштен туа болатын кемістіктің дамуы
Әйелдерге ҚҰӨТ жүргізгеннен кейін ұрықтың іштен туа болатын кемістігінің көп таралғандығы табиғи ұрықтану кезіндегі кемістіктер санынан аздап жоғары болуы мүмкін, бұл ата-аналарының жекелей ерекшеліктерінің (мысалы, анасының жасы, сперма сипаттамасы т.б.) нәтижесі болуы мүмкін.
Тромбоэмболиялық бұзылулар
Тұқым қуалаған бейімділігі, семіздік (дене салмағының индексі > 30 кг/м2) немесе тромбофилия салдарынан тромбоэмболиялық жағдайдың даму қаупі жоғары болатын әйелдерде гонадотропинмен емдеу кезінде де, сонымен қатар онымен емдеуден кейін де веналық немесе артериялық тромбоэмболиялық бұзылулар дамуы мүмкін. Жүктіліктің өзінше де тромбоэмболиялық асқынулар қаупі жоғары болатындығын атап өткен жөн.
Еркектер
Эндогенді ФСГ деңгейінің жоғары болуы алғашқы тестикулярлы бұзылулардың бар екендігін айғақтайды. Мұндай пациенттер Меногон/ХГГ қолдана отырып жүргізілген емге әсер бермейді.
Емдік әсерін емдеуді бастағаннан кейін 4-6 айдан соң спермаға жасалған талдама бойынша бағалайды.
Дәрілік заттың көлікті басқару және қзғалыстағы механизмдермен қызмет көрсету қабілетіне ықпал ету ерекшеліктері
Автокөлікті және қауіпті механизмдерді басқарған кезде, жағымсыз әсерлерді есепке ала отырып, сақ болған жөн.
Артық дозалануы
Симптомдары: анабездердің гиперстимуляциясы синдромының дамуы мүмкін.
Емдеу: Гиперстимуляцияның І дәрежелі жеңіл дәрежесінде анабездердің аздап ұлғайғаны (анабездер өлшемі 5-7 см) байқалады, стероидты гормондардың шамадан тыс секрециясы және абдоминальді ауырсынулар байқалады, осы дәрежеде ерекше ем жүргізу қажет етілмейді. Пациент әйелдер мұқият медициналық бақылауда болуға тиіс. ІІ дәрежелі гиперстимуляцияда анабездерде өскін (анабездер өлшемі 8-10 см), абдоминальді симптомдар, жүректің айнуы және құсу байқалуы мүмкін, осы дәрежеде клиникалық бақылау жүргізіледі және симптоматикалық ем қолданылады немесе, қажет болған жағдайда, гемоконцентрациясы жоғары қан алмастырғыштар вена ішіне енгізіленді. ІІІ дәрежелі ауыр дәрежелі гиперстимуляция анабездер өскінінің ұлғаюымен (анабездер өлшемі > 10 см), асцитпен, гидроторакспен, абдоминальді симптомдармен, ентікпемен, тұздардың шығарылуының кідіруімен, қанның ұюымен, қанның қоюлығының жоғарылауымен, тромбоциттердің бірігуі артып, тромбоэмболияның даму қаупінің болуымен қоса жүруі мүмкін, осы дәрежеде пациент әйелдің міндетті түрде ауруханаға жатқызу қажет, өйткені мұндай жағдайларда өмірге қауіп төндіретін жағдайлар даму мүмкін, ол қарқынды медициналық жәрдемді қажет етеді.
Шығарылу түрі және қаптамасы
Құрамында 75 ХБ фолликулостимуляциялайтын гормоны және 75 ХБ лютеинизирлеуші гормоны бар препарат түссіз шыны ампулаларда.
1 мл еріткіш бақыланатын сындыру нүктесі бар түссіз шыны ампулада.
Препараты бар 5 ампула және еріткіші бар 5 ампула пішінді ұяшықты қаптамаға салынған. 1 немесе 2 пішінді ұяшықты қаптамадан медициналық қолдану жөніндегі мемлекеттік және орыс тілдеріндегі нұсқаулықпен бірге картон қорапқа салынады.
Сақтау шарттары
Түпнұсқалық қаптамасында, 25 ºС-ден аспайтын температурада сақтау керек.
Балалардың қолы жетпейтін жерде сақтау керек!
Сақтау мерзімі
3 жыл
Дайындалған ерітіндіні сұйылтқаннан кейін дереу пайдалану керек.
Қаптамасында көрсетілген жарамдылық мерзімі өткеннен кейін пайдаланбау керек.
Дәріханалардан босатылу шарттары
Рецепт арқылы
Өндіруші
Ферринг ГмбХ, Германия
Wittland 11, 24109,Keil, Germany
Тіркеу куәлігінің иесі
Ферринг ГмбХ, Германия
Қазақстан Республикасы аумағында тұтынушылардан өнім (тауар) сапасы жөніндегі шағымдарды қабылдайтын және тіркеуден кейін дәрілік заттың қауіпсіздігін бақылауға жауапты ұйымның мекенжайы
Қазақстан Республикасындағы «Ферринг Фармацевтикалс С.А.» өкілдігі
Қазақстан Республикасы
Алматы қ., Наурызбай батыр к-сі, 99/1 үй, 41Б кеңсе
тел./факс: +7(727) 311 5447
МЕНОПУР (менотропин)
Қазақстан Республикасы
Денсаулық сақтау министрлігі
Фармация комитеті Төрағасының
2018 жылғы “02” 02
№ N013379 бұйрығымен
БЕКІТІЛГЕН
Дәрілік затты медициналық қолдану жөніндегі нұсқаулық
Менопур
Саудалық атауы
Менопур
Халықаралық патенттелмеген атауы
Жоқ
Дәрілік түрі
Инъекция үшін ерітінді дайындауға арналған лиофилизацияланған ұнтақ (75 ХБ ФСГ және 75 ХБ ЛГ) еріткішпен жиынтықта
Құрамы
Бір құтының ішінде
белсенді зат - менотропин (жоғары тазартылған адамның менопаузалық гонадотропині, аМГ), бұл 75 ХБ ФСГ-ге (фолликулостимуляциялайтын гормон) және 75 ХБ ЛГ-ге (лютеиндейтін гормон) сәйкес келеді,
қосымша заттар: лактоза моногидраты, полисорбат 20, натрий гидроксиді, хлорсутек қышқылы.
Еріткіш: натрий хлориді, 10% хлорсутек қышқылы, инъекцияға арналған су.
Сипаттамасы
Ақ немесе ақ дерлік түсті түйіршік түріндегі лиофилизацияланған масса
Фармакотерапиялық тобы
Урогенитальді ағзалар ауруларын емдеуге арналған препараттар және жыныс гормондары. Жыныс гормондары және жыныс жүйесінің модуляторлары. Гонадотропиндер және басқа овуляция стимуляторлары. Гонадотропиндер. Менопаузалық гонадотропин.
АТХ коды G03GA02
Фармакологиялық қасиеттері
Фармакокинетикасы
Қан плазмасында фолликулостимуляциялайтын гормон (ФСГ) ең жоғары деңгейге препаратты бұлшықет ішіне енгізгеннен кейін 6-24 сағаттан соң жетеді. Осыдан кейін қандағы ФСГ концентрациясы біртіндеп төмендейді. Гонадотропиндердің жартылай шығарылу кезеңі 4-12 сағат.
Фармакодинамикасы
Менопур адамның жоғары дәрежеде тазартылаған менопаузалық гонадотропині препараты болып табылады. Препараттың құрамында фолликулостимуляциялайтын және лютеиндейтін гормондар 1:1 арақатынаста, 75 ХБ ФСГ және ЛГ-ден, олар адам гипофизінен өндіріледі. Әсер етуші заты постменопауза кезеңінде әйелдердің несебінен алынады. Менопур әйелдерде қандағы эстрогендер деңгейін, аналық бездің өсуін және жетілуін арттырады.
Қолданылуы
Әйелдерде:
- кломифен цитратымен емдеуге жауап бермейтін әйелдерде ановуляциядан болған (поликистоздық аналық без синдромын қоса) әйел бедеулігінде
- қосымша репродукциялық технологиялар (ҚРТ) жүргізген кезде фолликулдардың көптеп өсуін индукциялау мақсатында аналық бездің бақыланатын гиперстимуляциясында, мысалы, in vitro ұрықтандырғанда, сондай-ақ сперматозоидтардың интраплазмалық инъекциясын жасағанда
Еркектерде:
- алғашқы немесе салдарлық гипогонадотроптық гипогонадизмнен болатын азооспермияда немесе олигоастеноспермияда сперматогенезді стимуляциялау үшін (аХГ препараттарымен біріктіріп).
Қолдану тәсілі және дозалары
Менопур теріастына немесе бұлшықет ішіне қолдануға арналған. Ұнтақты тура енгізер алдында препараттың жанына қоса салынған еріткішті пайдалана отырып ерітеді. 1 мл еріткіште 3 құты Менопур ұнтағы ерітілуі мүмкін. Сілкілеуге жол бермеген жөн. Ерітіндіні, егер онда бөлшектер болса және мөлдір болмаса, қолданбау керек. Менопур препаратымен емдеуді тиісінше маманданған және бедеулікті емдеу тәжірибесі бар дәрігердің бақылауымен жүргізген жөн.
Төменде сипатталған препарат дозасы т/а, сонымен қатар б/і енгізу тәсілінде де бірдей. Аналық бездердің гонадотропиндерді енгізуге бірдей әсер бермейтіндігі анықталды. Осы себепті дозалаудың әмбебап сызбасын жасап шығару мүмкін емес. Доза аналық бездердің реакциясына байланысты жекелей таңдап алынуы тиіс. Менопур препаратын монотерапия түрінде немесе гонадотропин-рилизинг-гормон (ГнРГ) агонистерімен немесе антагонистерімен біріктіріп қолданады. Ұсынылатын дозалар және емдеу ұзақтығы қолданылатын емдеу сызбасына байланысты.
Әйелдерде:
Ановуляция (АПКС-ны қоса)
Менопур препаратымен емдеудің мақсаты жетілген бір фолликулдың дамуы болып табылады, хориондық гонадотропин (аХГ) препараттарын енгізгеннен кейін одан ооцит шығады.
Емдеуді әдетте етеккір оралымының алғашқы 7 күні ішінде бастайды. Менопур препаратының ұсынылатын бастапқы дозасы кем дегенде 7 күн бойы тәулігіне 75–150 ХБ құрайды. Әрі қарай емдеу сызбасын қан плазмасында эстрадиол концентрациясын анықтаумен бірге ультрадыбыстық зерттеу (УДЗ) нәтижелерінің негізінде аналық бездердің жүргізілген емге жауабына мониторинг жасағаннан кейін таңдайды. Аналық бездердің реакциясы болмағанда доза 1 реттен жиі емес 37,5 ХБ-ға (бір енгізу) арттырылады, әрбір кейінгі арттыру 75 ХБ-ден аспауы тиіс. Ең жоғары тәуліктік доза 225 ХБ-ден аспауы тиіс. Егер 4 аптаның ішінде емдік жауапқа қол жеткізілмесе, емдеуді тоқтату және өте жоғары бастапқы дозалармен жаңа циклді бастау керек.
Аналық бездердің адекватты жауабына қол жеткізген кезде келесі күні Менопур препаратының соңғы инъекциясынан кейін овуляцияны индукциялау үшін 5000-10000 ХБ аХГ бір рет енгізеді. Пациентке аХГ енгізген күні және енгізгеннен кейін келесі күні жыныстық қатынаста болу ұсынылады. Баламалы әдіс ретінде жатырішілік инсеминация жүргізілуі мүмкін. Пациент аХГ енгізгеннен кейін кем дегенде 2 апта бойы үнемі бақылауда болуы тиіс. Менопур препаратын енгізгенде аналық бездерде шамадан тыс реакциялар болса, емдеу курсын тоқтату және аХГ енгізуден бас тарту керек. Пациентке контрацепцияның бөгегіш әдістерін пайдалану немесе етеккір келгенше жыныстық қатынасты тоқтата тұру ұсынылады.
ҚРТ жүргізген кезде көптеген фолликулдардың өсуін индукциялау мақсатында аналық бездердің бақыланатын гиперстимуляциясы
ГнРГ агонистерін қолдану протоколына сай кері байланыс қағидасына сәйкес, Менопур препаратымен емдеуді ГнРГ агонистерімен емдеуді бастағаннан кейін шамамен 2 аптадан соң тағайындаған жөн. Егер емдеу сызбасы ГнРГ агонистерін алдын ала қолдануды шамаламаса, Менопур препаратын енгізуді етеккір оралымының 2 немесе 3 күні ГнРГ антагонистерімен бірге бастаған жөн. Менопур препаратының ұсынылатын бастапқы тәуліктік дозасы емдеудің алғашқы 5 күні ішінде 150-225 ХБ құрайды. Әрі қарай емдеу сызбасын қан плазмасында эстрадиол концентрациясын анықтаумен бірге УДЗ нәтижелерінің негізінде аналық бездердің жүргізілген емге жауабына мониторинг жасағаннан кейін таңдайды. Ұсынылатын жоғары доза 150 ХБ-ден аспауы тиіс. Менопур препаратының ең жоғары тәуліктік дозасы 450 ХБ-ден аспауы тиіс. Емдеудің жалпы ұзақтығы 20 күннен аспауы тиіс.
Аналық бездердің оңтайлы жауабына қол жеткізген кезде Менопур препаратының соңғы инъекциясынан кейін фолликулдардың ақырғы жетілуін индукциялау және ооциттің шығуын индукциялау үшін 10000 ХБ доза аХГ бір инъекциясы тағайындалады. Пациент аХГ-ні енгізгеннен кейін 2 апта бойы үнемі бақылауда болуы тиіс. Менопур препаратын енгізуге аналық бездер шамадан тыс реакция берген жағдайда емдеу курсын тоқтату және аХГ енгізуден бас тару қажет. Пациентке контрацепцияның бөгегіш әдістерін пайдалану немесе етеккір басталғанша жыныстық қатынасты тоқтата тұру ұсынылады.
Еркектерде:
Гипогонадотроптық гипогонадизмде сперматогенезді стимуляциялау үшін еркектерде, егер мұның алдындағы 4-6 ай бойы аХГ препараттарымен емдеу (аптасына 3 рет 1500-5000 ХБ аХГ енгізу) қан плазмасындағы тестостерон концентрациясының қалыпқа келуіне әкелсе, Менопур препаратын аптасына 3 рет 75 ХБ-ден 150 ХБ-ге дейінгі дозада аптасына 3 рет 1500 ХБ аХГ инъекциясымен бірге қолдану ұсынылады. Осы сызба бойынша емдеуді сперматогенез жақсарғанша кем дегенде 4 ай бойы жалғастырған жөн. Осы уақыт ішінде оң әсер болмаған жағдайда біріктірілген ем емдеуден оң нәтиже алынғанша жалғастырылуы мүмкін. Зерттеулерге сәйкес, сперматогенезді жақсарту үшін кем дегенде 18 ай емдеу іске асырылуы мүмкін.
Жағымсыз әсерлері
Жағымсыз әсерлердің жиілігі: жиі (≥ 1/100 <1/10 дейін), жиі емес (≥ 1/1000 <1/100 дейін), сирек (≥ 1/10000 <1/1000 дейін), жиілігі анықталмаған (қазіргі таңда жағымсыз реакциялардың таралуы жөнінде деректер жоқ, препаратты тіркеуден кейін қолдану кезеңінде тіркелген).
Клиникалық зерттеулерде Менопур препаратын қолданған кезде 5%-ға дейін байқалған өте күрделі және жиі жағымсыз реакциялар, аналық бездердің гиперстимуляциясы синдромы (АГС), іштің ауыруы, бас ауыру, іштің желденуі және инъекция жасалған жердің ауыруы болды. Клиникалық зерттеулерде және тіркеуден кейінгі қолдану барысында байқалған негізгі жағымсыз реакциялар төменде кестеде берілген.
|
Жүйелік-ағзалық класс |
Жиі (≥1/100, <1/10) |
Жиі емес (≥1/1000, <1/100) |
Сирек (≥1/10000, <1/1000) |
Жиілігі белгісіз |
|
Иммундық жүйе тарапынан бұзылулар |
|
|
|
Жергілікті немесе жалпы аллергиялық реакциялар, соның ішінде анафилаксиялық реакциялар |
|
Жүйке жүйесі тарапынан бұзылулар |
Бас ауыру |
Бас айналу |
|
|
|
Көру ағзалары тарапынан бұзылулар |
|
|
|
Өткінші соқырлық, диплопия, мидриаз, скотома, фотопсия, шыны тәрізді дененің өткінші бұлыңғырлануы, көру жітілігінің нашарлауы |
|
Қантамырлар тарапынан бұзылулар |
|
Ысынулар |
|
Тромбоэмболиялық құбылыстар |
|
Асқазан-ішек жолы тарапынан бұзылулар |
Іштің ауыруы, іштің кебуі, жүректің айнуы, іш көлемінің ұлғаюы |
Құсу, іште жайсыздық, диарея |
|
|
|
Тері және теріасты тіндері тарапынан бұзылулар |
|
|
Безеу бөртпе, тері бөртпелері |
Терінің қышынуы, есекжем |
|
Қаңқа-бұлшықет және дәнекер тіні тарапынан бұзылулар |
|
|
|
Буындардың ауыруы, арқаның және мойынның ауыруы, аяқ-қолдың ауыруы |
|
Жыныс ағзалары және сүт бездері тарапынан бұзылулар |
АГС*, жамбас ауыруы (жатыр қосалқылары аймағының ауыруы); еркектерде - гинекомастия |
Аналық бездердің кистасы, сүт бездерінің ауыруы және жайсыздығы, сүт бездерінің қатаюы және ісінуі, емізікшелердің ауыруы |
Жамбас қуысында сұйықтықтың жиналуы |
Аналық бездің ширатылып қалуы |
|
Жалпы бұзылыстар және енгізген жердің бұзылулары |
Инъекция жасалған жердің ауыруы |
Қатты қажығыштық |
|
Енгізген жерде гипертермия, дімкәстік |
|
Зертханалық және аспаптық деректер |
|
|
|
Дене салмағының артуы |
* Клиникалық зерттеулерде Менопур препаратын қолданған кезде АГС дамуымен байланысты асқазан-ішек жолы тарапынан іштің кебуі және іштің жайсыздануы, жүректің айнуы, құсу және диарея сияқты бұзылулар. Ауыр АГС жағдайларында сирек асқынулар ретінде асцит және жамбас қуысында сұйықтықтың жиналуы, экссудативті плеврит, ентігу, олигуриялар, тромбоэмболиялық асқынулар және аналық бездің ширатылып қалуы пайда болуы мүмкін.
Егер нұсқаулықта көрсетілген жағымсыз әсерлердің кез келгені өршісе, немесе Сіз нұсқаулықта көрсетілмеген басқа да жағымсыз әсерлерді байқасаңыз, оны дәрігерге мәлімдеңіз.
Қолдануға болмайтын жағдайлар
- препарат компоненттеріне және еріткішке жоғары сезімталдық;
- гипофиздің және гипоталамустың ісіктері;
- 18 жасқа дейінгі балалар;
-бауыр және бүйрек функцияларының бұзылуы.
Әйелдерде:
- аналық без, жатыр немесе сүт бездерінің обыры;
- жүктілік және емшек емізу кезеңі;
- этиологиясы айқын емес қынаптық қан кетулер;
- кистаның болуы немесе аналық бездер көлемінің АПКС-мен байланысты емес ұлғаюы;
- аналық бездер функциясының алғашқы жеткіліксіздігі;
- жүктілікпен үйлеспейтін жыныс ағзалары дамуының аномалиялары;
- жүктілікпен үйлеспейтін жатыр миомасы;
-мезгілінен ерте болатын менопауза.
Еркектерде:
- қуық асты безінің обыры;
- аталық без ісігі;
- аталық без функциясының алғашқы жеткіліксіздігі.
Дәрілермен өзара әрекеттесуі
Клиникалық тәжірибенің жоқтығына қарамастан, Менопурды кломифенмен бір мезгілде қолдану фолликулдардың жетілу реакциясын күшейтуі мүмкін деп күтіледі. Гипофизарлы десенсибилизация мақсатында гонадотропин-рилизинг фактор агонистерімен бірге қолданғанда аналық бездер тарапынан қалаған әсерге қол жеткізу үшін Менопурдың жоғары дозалары қолданылуы мүмкін.
Айрықша нұсқаулар
Менопур – ауырлық дәрежесі әртүрлі жағымсыз әсерлерді туындатуға қабілетті, күшті әсер ететін гонадотропты препарат, оны бедеулікті емдеу әдістерін жақсы меңгерген дәрігердің бақылауымен ғана қолданған жөн.
Гонадотропиндермен емдеу дәрігерлерден белгілі бір уақытты жұмсауды қажет етеді және, мүмкіндігінше, қан плазмасындағы эстрадиол деңгейін анықтаумен біріктірілген ультрадыбыстық зерттеуді қамтитын, аналық бездердің емге реакциясын ұдайы бақылап отыруды талап етеді.
Пациенттер арасында менотропинді енгізуде маңызды айырмашылықтар бар, олардың кейбіреулерінде емдеуге өте төмен жауап болуы ықтимал. Емдеу мақсатына сәйкес келетін ең төмен дозаны қолданған жөн.
Менопурдың алғашқы инъекциясын дәрігердің бақылауымен жасаған жөн.
Емдеуді бастамас бұрын, серіктес жұптың екеуінде де бедеулік себебіне зерттеу жүргізу, сондай-ақ ықтимал қарсы көрсетілімдеріне қатысты медициналық тексеру жүргізу қажет. Атап айтқанда, пациентте гипотиреоидизмнің, адренокортикальді жеткіліксіздіктің, гиперпролактинемияның, гипофизарлық немесе гипоталамиялық ісіктердің бар-жоқтығын тексеру, мұндай патологиялық жағдайларда қарастырылған тиісті емді тағайындау қажет.
Фолликулдардың өсу стимуляциясы ановуляция нәтижесінде бедеулікті емдеу аясында, сонымен қатар қосымша репродукциялық технологиялар (ҚРТ) бағдарламасы аясында жүргізілетін пациенттерде аналық бездер көлемінің ұлғаюы байқалуы немесе аналық бездердің гиперстимуляциясы синдромы дамуы мүмкін. Менопурдың ұсынылған дозалау режимін сақтау және емге аналық бездердің реакцияларын мұқият бақылау осы жағымсыз әсерлердің даму қаупін барынша азайтуға жәрдемдеседі. Фолликулдардың жетілу көрсеткіштеріне экспресс-баға беру дәрігерден тиісінше тәжірибені және мұндай тестілердің интерпретациясын талап етеді.
Аналық бездердің гиперстимуляциясы синдромы (АГС)
АГС – аналық бездердің асқынбаған ұлғаюынан айырмашылығы бар жағдай. АГС өздігінен пайда болатын синдром болып табылады, ал оның симптомдарының ауырлығы ұлғаюы мүмкін.
Синдром аналық бездер көлемінің едәуір ұлғаюымен, жыныстық стероидты гормондар деңгейінің жоғарылауымен, сондай-ақ қан айналымы тамырларының жоғары өткізгіштігімен көрініс береді, бұл сұйықтықтардың құрсақ, плевралық және, төтенше жағдайларда – перикардиальді қуыстарға жиналуына әкелуі мүмкін.
АГС-тің ауыр жағдайларында келесі симптомдар байқалуы мүмкін: іштің ауыруы, іштің кебуі, аналық бездердің едәуір ұлғаюы, дене салмағының артуы, ентігу, олигурия және гастроинтестинальді, мысалы, жүректің айнуы, құсу және диарея сияқты симптомдар. Клиникалық тексерулер кезінде гиповолемияны, электролиттік теңгерімнің бұзылуын, асцитті, гемоперитонеумді, плевралық жалқықты, гидротораксті, жедел өкпелік дистресс-синдромды және тромбоэмболия көріністерін байқауға болады.
Гонадотропинмен емдеуге аналық бездердің жоғары реакциясы, овуляцияны стимуляциялау үшін аХГ қолданған жағдайлардан басқасында, АГС-ке сирек әкеледі. Сондықтан АГС пайда болған жағдайда аХГ жәрдемімен стимуляцияны қолдануды тоқтата тұрған, сондай-ақ пациенттерге кем дегенде 4 күн бойы жыныстық қатынастан бас тарта тұру немесе контрацепцияның бөгегіш әдістерінен пайдалану ұсынылады. АГС тез басталуы мүмкін (тәуліктен бастап бірнеше күнге дейін) және күрделі жағымсыз әсер болып табылады, сондықтан пациенттер ХГГ енгізуден кейін кем дегенде 2 апта дәрігердің бақылауында болуы керек.
Менопурдың ұсынылған дозалау режимін сақтау және емделу кезінде мұқият бақылау аналық бездер гиперстимуляциясының және көп ұрықты жүктіліктің туындау қаупін барынша азайтуға мүмкіндік береді. Қосымша репродукциялық технологиялар (ҚРТ) жүргізген кезде овуляция басталғанша барлық фолликулдардың аспирациясы гиперстимуляцияның туындау қаупін азайтуға жәрдемдеседі.
АГС ауыр түрде болуы және жүктілік басталған жағдайда ұзақ болуы мүмкін. Әдетте АГС етеккір басталған кезде өздігінен қайтады.
Ауыр жағдайларда АГС гонадотропин енгізуді тоқтату қажет, ал пациентті арнайы емдеу үшін ауруханаға жатқызған жөн.
Синдром аналық бездердің поликистозы бар пациенттерде жиі дамиды.
Көп ұрықты жүктілік
Көп ұрықты жүктіліктен, әсіресе ұрықтар саны көп болғанда, перинатальді кезеңде ана үшін де, сонымен қатар шарана үшін де асқынулар қаупі жоғары болады.
Гонадотроптық гормонмен емделу нәтижесінде овуляция басталатын пациенттерде, табиғи ұрықтану нәтижесіндегі жүктілікпен салыстырғанда, көп ұрықтық жағдайлар жиілейді. Көп ұрықтық қаупін барынша азайту үшін әйелдерде аналық бездердің реакциясына мұқият бақылау жүргізу қажет.
Пациентте ҚРТ жүргізгеннен кейін көп ұрықты жүктіліктің қаупі, негізінен, эмбриондардың санына, олардың сапасына және пациенттің жасына байланысты.
Емдеуді бастағанға дейін пациентке оларда көп ұрықты жүктілік пайда болуы мүмкін екендігін алдын ала ескерткен жөн.
Жүктілікті көтере алмау
Жүктілікті үзу немесе өздігінен түсік тастау нәтижесінде жүктілікті көтере алмау жағдайларының саны, фолликулдардың жетілу стимуляциясына ұшыраған немесе қосымша репродукциялық технологиялық (ҚРТ) бағдарламасынан өткен әйелдерде, табиғи ұрықтану жағдайына қарағанда, жоғары.
Жатырдан тыс жүктілік
Жатыр түтіктерінің ауруы бар әйелдерде, сау ұрықтану және бедеулікті емдеу жағдайларына қарағанда, жатырдан тыс жүктіліктің даму қаупі үлкен болады. Іn vitro фертилизация жүргізгеннен кейін эктопиялық жүктіліктің жиілігі, популяциядағы 1-1,5%-бен салыстырғанда, 2-5% құрайды.
Репродукциялық ағзалардағы жаңа түзілімдер
Бедеулікке байланысты дәрі-дәрмектік емді бірнеше мәрте қабылдаған әйелдерде аналық бездердің және репродукциялық жүйенің басқа да ағзаларының қатерсіз де, сонымен қатар қатерлі де жаңа түзілімдерінің дамығаны жөнінде мәлімделді. Бүгінде гонадотропинді қолданып емдеу мен бедеулікпен науқастанатын әйелдердегі жаңа түзілімдерге бейімділік арасындағы байланыс әлі де анықталған жоқ.
Дамудың туа біткен кемістіктері
ҚРТ жүргізгеннен кейін әйелдерде туа біткен кемістіктер дамуының таралуы табиғи ұрықтанған кездегі кемістіктер санынан аздап артуы мүмкін. Бұл ата-аналардың жекелей ерекшеліктерінің (анасының жасы, сперманың сипаттамасы және т.б.) және көп ұрықты жүктілік нәтижесінен болуы мүмкін деп саналады.
Тромбоэмболиялық бұзылулар
Тұқым қуалайтын бейімділігіне, бұрыннан бар семіздігіне (дене салмағының индексі > 30 кг/м2) немесе тромбофилияға қарамастан, тромбоэмболиялық жағдайдың даму қаупі жоғары болатын әйелдерде гонадотропинмен емделу кезінде, сонымен қатар емдеуді аяқтағаннан кейін де веноздық немесе артериялық тромбоэмболиялық бұзылулар дамуы мүмкін. Жүктілікте өздігінен тромбоэмболиялық асқынулардың жоғары қаупі болатындығын атап өткен жөн.
Менопурды қолдану допинг-тестінің оң нәтижесіне әкеп соғуы мүмкін.
Менопурды допинг ретінде қолдану денсаулық жағдайын нашарлатуы мүмкін.
Препараттың құрамында лактоза бар, сондықтан оны галактоза жақпаушылығы, лактаза жеткіліксіздігі немесе глюкоза-галактаза мальабсорбциясы синдромының сирек тұқым қуалайтын түрлері бар пациенттерге қолданбаған жөн.
Жүктілік немесе емшек емізу кезеңінде қолданылуы
Жүктілік және емшек емізу кезеңінде Менопурды қолдануға болмайды.
Балалар
Балаларға тағайындамайды.
Көлік құралын және потенциалды қауіпті механизмдерді басқару қабілетіне дәрілік заттың ықпал ету ерекшеліктері
Ықпалын тигізбейді.
Артық дозалануы
Симптомдары: аналық бездердің гиперстимуляциясы синдромы дамуы мүмкін.
Симптоматикалық емі
Аналық бездердің аздап (аналық бездердің өлшемі 5-7 см) артуымен, стероидты гормондардың шамадан тыс секрециясымен және іштің ауыруымен қатар жүретін жеңіл дәрежедегі (І дәрежедегі) гиперстимуляция жағдайында арнайы сақтық шараларын қабылдау қажеттілігі жоқ. Пациентті осы жағдайдың себептері жөнінде хабардар ету және оны мұқият бақылау қажет.
Іштің ауыруымен, жүректің айнуымен және құсумен қатар жүретін, аналық бездер кистасы (аналық бездің өлшемі 8-10 см) түзілетін ІІ дәрежедегі гиперстимуляцияда мұқият клиникалық зерттеу жүргізу қажет, гемоглобиннің жоғары деңгейі жағдайында вена ішіне құю жәрдемімен айналымдағы қанды алмастыру қажет болады.
Асцитпен, гидроторакспен, іштің кебуімен, іштің ауыруымен, диспноэмен, организмде тұздың жиналуымен, гемоглобин деңгейінің жоғарылауымен, қанның жоғары тұтқырлығымен, тромбоэмболиялық асқынулар қаупі бар тромбоциттер агрегациясымен қатар жүретін, аналық бездердің үлкен кистасы (аналық бездердің өлшемі 10 см-ден көбірек) түзілетін ІІІ дәрежедегі гиперстимуляцияда ауруханаға шұғыл түрде жатқызу қажет.
Шығарылу түрі және қаптамасы
Резеңке тығыны, көгілдір түсті пластмассадан жасалған қорғаныш қақпағы бар алюминий қалпақшамен қаусырылған түссіз шыны құтыларда 75 ХБ фолликулостимуляциялайтын гормоннан және 75 ХБ лютеиндейтін гормоннан.
Түрлі түсті бақыланатын нүктесі бар I типті шыны түссіз шыны ампулаларда 1 мл еріткіштен.
Құтыларға және ампулаларға өздігінен желімденетін заттаңба жапсырылған.
Пішінді ұяшықты қаптамаға препараты бар 5 құтыдан және еріткіші бар 5 ампуладан салынған.
Пішінді 1 немесе 2 қаптама медициналық қолдану жөнінде мемлекеттік және орыс тілдеріндегі нұсқаулықпен бірге картон қорапшаға салынған.
Сақтау шарттары
25ºС-ден аспайтын температурада, жарықтан қорғалған жерде сақтау керек.
Балалардың қолы жетпейтін жерде сақтау керек!
Сақтау мерзімі
2 жыл
Дайындалған ерітіндіні сұйылту бойына бірден пайдалану керек.
Жарамдылық мерзімі өткеннен кейін қолдануға болмайды.
Дәріханалардан босатылу шарттары
Рецепт арқылы
Өндіруші және тіркеу куәлігінің ұстаушысы:
Ферринг ГмбХ, Германия
Wittland 11,24109 Kiel, Germany
Тұтынушылардан дәрілік заттың сапасы жөніндегі шағымдарды (ұсыныстарды) Қазақстан Республикасы аумағында қабылдайтын және тіркеуден кейін дәрілік заттың қауіпсіздігін бақылауға жауапты ұйымның атауы, мекенжайы және байланыс деректері
«Ферринг Фармацевтикалс С.А.» Қазақстан Республикасындағы өкілдігі
Қазақстан Республикасы, Алматы қ., 050000, Алмалы ауданы,
Наурызбай батыр к-сі, 99/1 үй, 41б кеңсе.
Тел./факс: +7(727) 311-54-47
МЕНОПУР (менотропин)
Қазақстан Республикасы
Денсаулық сақтау министрлігі Фармация комитеті Төрағасының
2018 жылғы “17” 05
№ N015075, N015076 бұйрығымен
БЕКІТІЛГЕН
Дәрілік затты медициналық қолдану жөніндегі нұсқаулық
Менопур
Саудалық атауы
Менопур
Халықаралық патенттелмеген атауы
Жоқ
Дәрілік түрі
Инъекция үшін ерітінді дайындауға арналған лиофилизацияланған 600 ХБ және 1200 ХБ ұнтақ еріткішпен жиынтықта
Құрамы
Бір құтының ішінде
Менопур 600 ХБ
белсенді зат – жоғары сапада тазартылған менотропин (менопаузалық адам гонадотропині) құрамында 600 ХБ ФСГ (фолликулостимуляциялаушы гормоны) және 600 ХБ ЛГ (лютеиндеуші гормоны))
Менопур 1200 ХБ
белсенді зат - жоғары сапада тазартылған менотропин (менопаузалық адам гонадотропині) құрамында 1200 ХБ ФСГ (фолликулостимуляциялаушы гормоны) және 1200 ХБ ЛГ (лютеиндеуші гормоны)
қосымша заттар: лактоза моногидраты, динатрий гидрофосфат гептагидраты, полисорбат 20, фосфор қышқылының 1 М ерітіндісі, натрий гидрофосфат гептагидратының 0.5 М ерітіндісі.
еріткіш: м-крезол, инъекцияға арналған су.
Сипаттамасы
Ақ немесе ақ дерлік түсті кесек түріндегі лиофилизацияланған ұнтақ
Еріткіш: Мөлдір түссіз ерітінді.
Фармакотерапиялық тобы
Урогенитальді ағзалар ауруларын емдеуге арналған препараттар және жыныс гормондары. Жыныс гормондары және жыныс жүйесінің модуляторлары. Гонадотропиндер және басқа овуляция стимуляторлары. Гонадотропиндер. Менопаузалық гонадотропин.
АТХ коды G03GA02
Фармакологиялық қасиеттері
Фармакокинетикасы
Тері астына енгізгеннен кейінгі менотропиннің биожетімділігі бұлшықет ішіне енгізуден кейінгіге қарағанда жоғары. 300 ХБ ФСГ және 300 ХБ ЛГ бұлшықет ішіне енгізілгеннен кейін алынған мәндер мынаны құрайды: AUC0-¥ = 320,1 мХБ/мл/сағ., Cmax = 4,15 мХБ/мл, tmax= 18 сағ.; тері астына енгізілгеннен кейін AUC0- = 385,2 мХБ/мл х сағ., Cmax = 5,62 мХБ/мл, tmax= 12 сағ. Жартылай шығарылу кезеңі бұлшықет ішіне енгізуден кейін 56 сағатты және тері астына енгізуден кейін 51 сағатты құрайды. Менотропин көбіне бүйрек арқылы шығарылады.
Ерекше топтағы пациенттер фармакокинетикасы
Бүйрек немесе бауыр жеткіліксіздігі бар пациенттерде «Менопур» препаратының фармакокинетикасы зерттелмеген.
Фармакодинамикасы
Менопур жоғары дәрежеде тазартылған менопаузалық адам гонадотропинінің препараты болып табылады. Препараттың құрамында фолликулостимуляциялаушы (ФСГ) және лютеиндеуші гормондар (ЛГ) 1:1 арақатынаста болады, 600 ХБ-ден немесе 1200 ХБ-ден ФСГ және ЛГ бар, олар адам гипофизінен өндіріледі. Әсер етуші заты постменопауза кезеңінде әйелдердің несебінен алынады. ФСГ және ЛГ белсенділігі бар менотропин аналық бездердің алғашқы жеткіліксіздігіне шалдықпаған әйелдерде фолликулдардың өсуі мен жетілуін, сондай-ақ стероидтардың гонадалық секрециясын индукциялайды. ФСГ ерте фолликулогенез сатысында фолликулярлық өсуді іске асырады, ал ЛГ овариальді стероидогенезге және фолликулдың овуляцияға дейінгі дамуына әкелетін физиологиялық үдерістерге қатысады.
Қолданылуы
Бедеулікте фолликулдардың пісіп жетілуін стимуляциялауға.
Монофолликулярлы стимуляция
- гипо- немесе нормогонадотроптық аменореяда, олигоменореяда
- кломифенмен емдеуге сезімтал емес әйелдерде ановуляторлы оралымдарда және лютеин фазасы жеткіліксіз болғанда
Мультифолликулярлы стимуляция
- қосымша ұрпақ өрбіту технологияларын (ҚҰТ) жүргізген кезде фолликулдардың көптеп өсуін индукциялау мақсатында аналық бездердің бақыланатын суперовуляциясында
Қолдану тәсілі және дозалары
Менопур препаратымен емдеу дәрігердің бақылауымен жүргізілуі тиіс.
Препаратты жанына қоса салынған еріткіште еріткеннен кейін тері астына немесе бұлшықет ішіне енгізеді.
Дайындалған ерітінді көп реттік қолдануға арналған және 28 күн бойы сақталуы мүмкін.
Төменде сипатталған дозалау режимі тері астына енгізуде де, сонымен қатар бұлшықет ішіне енгізуде де ұқсас.
Препарат дозасы аналық бездің реакциясына байланысты жекелей таңдап алынады, және аналық бездің ультрадыбыстық зерттеу нәтижесіне және қандағы эстрадиол деңгейіне қарай түзетіледі.
Менопур жекелей де, сонымен қатар гонадотропин-рилизинг-гормонының (ГнРГ) агонисімен немесе антагонисімен біріктіріліп те қолданылуы мүмкін.
Емдеу ұзақтығы пациенттің жекелей ерекшеліктеріне және қолданылатын емдеу хаттамасына байланысты.
Монофолликулярлы стимуляция
Менопурды қолдануды етеккір оралымының алғашқы 7 күні ішінде бастау керек. Ұсынылатын бастапқы дозасы күніне 75 ХБ (немесе әрбір 2 күн сайын 150 ХБ) құрайды. Клиникалық бақылау нәтижелерін (аналық бездерді ультрадыбыстық тексеруді және/немесе эстрадиол деңгейін бақылауды қоса) негізге ала отырып, ары қарай емдеу режимін жекелей таңдаған жөн. Емдеу эстрогеннің тиісті деңгейіне (эстрадиолдың плазмадағы мөлшері – 1.1-2.9 нмол/л = 300-800 пг/мл) және фолликулдардың тиісінше жетілуіне (диаметр ≤18 мм) қол жеткізілгенге дейін жалғасады. Нәтиже болмаған жағдайда емдеу тоқтатылуы немесе арттырылған дозада жалғастырылуы мүмкін, бірақ мұны 7 күн ішінде бір реттен жиі жасамау керек. Ұсынылатын дозаның бір реттік арттырылуы 37,5 ХБ құрайды, бірақ 75 ХБ-ден аспауы тиіс. Препараттың ең жоғарғы тәуліктік дозасы 225 ХБ-ден аспауы тиіс. Емдеу курсы ең көп дегенде 7 - 12 күнге созылады. Егер плазмалық эстрогеннің деңгейі тым тез (2-3 күнде 100%-дан көбірек) жоғарыласа, Менопур дозасы азайтылуы тиіс. Егер Менопур ФСГ-мен біріктіріп қолданылса, Менопур дозасы сәйкесінше азайтылуы тиіс.
Оңтайлы нәтижеге қол жеткізген кезде Менопурдың соңғы енгізілген дозасынан кейін келесі күні хориондық гонадотропты гормонның (ХГГ) 5000-нан 10000 ХБ-ге дейінгі бір реттік дозасын енгізу керек. Пациент әйелге ХГГ енгізілген күні және келесі күні жыныстық қатынаста болу ұсынылады. Баламалы тәсілі жатырішілік жасанды ұрықтандыру жүргізу болып табылады. Пациент әйел ХГГ енгізгеннен кейін 2 апта бойы мұқият бақылауда болуы тиіс.
Егер Менопурды қолдануға шамадан тыс реакция байқалса, емдеу курсын тоқтату және ХГГ енгізбеу керек. Пациент әйел келесі етеккірлік қан кету басталғанға дейін контрацепцияның бөгеттік әдісін пайдалануы немесе жыныстық қатынастан бас тартуы тиіс.
Мультифолликулярлы стимуляция
ГнРГ агонисі қолданылатын емдеу курсынан өткен пациенттерде агониспен емдеуді бастағаннан кейін шамамен 2 аптадан соң Менопурмен емдеуді бастаған жөн. Менопурдың ұсынылатын тәуліктік дозасы емдеудің алғашқы 5 күні бойы 150-225 ХБ құрайды.
Клиникалық бақылауларға (ультрадыбыстық зерттеу және/немесе эстрадиол деңгейін бақылау) негіздейтін болсақ, кейінгі дозалар жекелей болуы тиіс, бірақ 150 ХБ-дан арттырмау керек, ең жоғары тәуліктік доза – 450 ХБ. Емдеу ұзақтығы 20 күннен аспауы тиіс.
ГнРГ агонистерін қолданып десенсибилизация жүргізу қарастырылмаған хаттамаларды пайдаланғанда, Менопурмен қолданылатын емді етеккір оралымының 2-3 күні бастаған жөн. Менопурдың ұсынылған дозасы және дозалау режимі ГнРГ агонистерін қолданып жүргізілетін хаттамалардағыдай.
Организм оңтайлы реакцияға жеткізген кезде фолликулдың ақырғы жетілуін индукциялау және ооциттерді шығаруға дайындау үшін хориондық гонадотропты гормонның (ХГГ) 5000-нан 10000 ХБ-ге дейінгі бір реттік дозасы енгізіледі. Овуляция 32-48 сағат өткеннен кейін басталады. Пациент әйелге овуляция күтілетін уақытқа қарай ХГГ енгізген күннен бастап күн сайын жыныстық қатынаста болу ұсынылады. Пациент әйел ХГГ енгізілгеннен кейін 2 апта бойы мұқият бақылауда болуы тиіс.
Егер Менопурды қолданғанда шамадан тыс реакция байқалса, емдеу курсын тоқтату және ХГГ енгізуді тоқтату қажет. Пациент келесі етеккір оралымы басталғанға дейін контрацепцияның бөгеттік әдісін пайдалануы немесе жыныстық қатынастан бас тартуы тиіс.
Ерітіндіні дайындау
Ұнтақты қаптамаға салынған еріткішпен ғана сұйылтқан жөн. Сұйылтуға арналған инені еріткішпен алдын ала толтырылған шприцке жалғаңыз. Барлық еріткішті ішінде ұнтағы бар құтыға енгізіңіз. Ұнтақ мөлдір ерітіндіге дейін тез еруі тиіс. Керісінше жағдайда, мөлдір ерітінді алынғанға дейін құтыны айналдырыңыз. Қарқынмен сілкілеуге жол бермеген жөн. Мөлдір емес ерітіндіні немесе ішінде көзге көрінетін бөлшектері бар ерітіндіні пайдалануға болмайды.
Енгізуге арналған шприцтер ФСГ және ЛГ 37,5-тен 600 ХБ-ге дейінгі бірліктермен межеленген. Енгізуге арналған шприцке препараттың тағайындалған дозасын құйып алыңыз және бірден енгізіңіз. 1 мл ерітіндінің ішінде 600 ХБ ФСГ және ЛГ бар.
Пайдалану кезінде қателікке бой алдырмау үшін, пациенттер «Менопур» 600 ХБ және «Менопур» 1200 ХБ препаратының көпдозалық құрамы көпдозалық инъекция үшін есептелгені жөнінде нақты хабардар болулары тиіс.
Жағымсыз әсерлері
«Менопур» препаратымен емделу кезеңінде жиірек хабарланған жағымсыз құбылыстарға іш аумағындағы ауыруы, бас ауыруы, енгізген жердегі реакция және енгізген жердегі ауыруы, сондай-ақ іштің кебуі жатады. «Менопур» препаратымен емдеу кезінде әйелдерде негізгі жағымсыз құбылыстар клиникалық зерттеулер шеңберінде және жүйелі-ағзалық класты (ЖАК) ескере отырып маркетингтен кейінгі байқаулар және жиілігі (жиі: ≥1%, <10%; мерзімді: ≥0,1%, <1%; сирек: ≥0,01%, <0,1%; өте сирек: <0,01%, белгісіз: көбінесе, нарықты зерттеу аясында өздігінен келіп түскен хабарламалар негізінде, жиілігін дәл анықтау мүмкін емес) төменде көрсетілген.
Иммун жүйесі тарапынан:
Өте сирек: аллергиялық реакциялар (жергілікті немесе жайылған)
Тағамдық және зат алмасу тарапынан:
Белгісіз: салмақтың артуы
Жүйке жүйесі тарапынан
Жиі: бас ауыруы
Кейде: бас айналуы
Көру мүшесі тарапынан:
Белгісіз: көрудің бұзылуы.
Жүрек және тамырлар тарапынан:
Сирек: венозды және артериялық тромбоэмболия, мысалы, терең вена тромбозы немесе өкпе эмболиясы сияқты (негізінен ауыр АГС бірге)
Асқазан-ішек жолы тарапынан
Жиі: іш аумағындағы ауыруы, жүрек айнуы, іштің кебуі.
Кейде: құсу, асқазандағы жайсыздық, диарея.
Тері және тері асты тіндері тарапынан бұзылулар
Сирек: акне, бөртпе
Белгісіз: қышыну, есекжем.
Қаңқа бұлшықеті және дәнекер тіндері тарапынан:
Белгісіз: қаңқабұлшықетінің ауыруы.
Ұрпақ өрбіту жүйе тарапынан:
Жиі: жамбас ауыруы, емшектің ісінуі, аналық бездің ұлғаюы, аналық бездің кистасы, көпұрықты жүктілік, жеңілден елеулі дәрежеге дейінгі аналық бездің гиперстимуляциясы
Сирек: ауыр дәрежедегі аналық бездің гиперстимуляциясы («Ескерту және сақтық шараларын» қараңыз)
Белгісіз: аналық бездің бұралуы.
Енгізген жердегі жалпы жағымсыз құбылыстар және жағымсыз реакциялар:
Жиі: енгізген жердегі жергілікті реакциялар (мысалға, ауыру), тұмау түрі бойынша симптомдар, мысалы, ысыну және буындардың ауыруы.
Кейде: шаршағыштық.
Белгісіз: пирексия, жайсыздықты сезіну.
Осы препараттың белсенді заты адамның несебінен бөлінеді. Шығу тегі белгілі және белгісіз патогенді организмдердің берілу қаупін, тиісінше толық бақылау мүмкін емес.
Қолдануға болмайтын жағдайлар
- әсер етуші затқа немесе қосымша заттардың кез келгеніне аса жоғары сезімталдық
- гипофиз немесе гипоталамус ісіктері, гиперпролактинемия
- қалқанша без және бүйрекүсті бездерінің ауыр аурулары себеп болған экстрагенитальді эндокринопатия
- аналық бездердің, жатырдың немесе сүт бездерінің карциномасы
- этиологиясы анықталмаған гинекологиялық қан кетулер
- аналық бездің кистасы немесе аналық бездердің поликистозды аналық бездер синдромымен байланысты емес ұлғаюы
- жүктілік және лактация кезеңі
- 18 жасқа дейінгі балалар мен жасөспірімдер
- аналық бездердің алғашқы дәрменсіздігі
- жыныс ағзаларының жүктілікпен үйлеспейтін ауытқушылығы
- жатырдың жүктілікпен үйлеспейтін фиброздық жаңа түзілімдері
- фолликулдардың қалыпты жетілуінің бұзылуынсыз бедеулік (қосымша ұрпақ өрбіту технологиялары (ҚҰТ) бағдарламаларына қатысатын пациенттерді қоспағанда)
Дәрілермен өзара әрекеттесуі
Басқа дәрілік заттармен араластырмау керек. Клиникалық тәжірибенің жоқтығына қарамастан, Менопурды және кломифен цитратын бір мезгілде қолдану фолликулдардың жетілу реакциясын күшейтуі мүмкін деп болжам жасалады. Гипофизарлы десенсибилизация мақсатында Менопурды ГнРГ агонистерімен бірге қолданғанда, аналық бездер тарапынан қалаған реакцияға қол жеткізу үшін Менопурдың жоғары дозалары қажет болуы мүмкін.
Менопур Бравель (урофоллитропин (ФСГ)) препаратымен біріктіріліп қолданылуы мүмкін. Зерттеулер осы препараттарды бірге енгізу олардың биожетімділігіне ықпалын тигізбейтіндігін көрсетті.
Менопур фолликулярлық өсуді стимуляциялағаннан кейін овуляцияны индукциялау мақсатында Хорагон препаратымен (адамның хориондық гонадотропині, аХГ) бірге қолданылуы мүмкін.
Айрықша нұсқаулар
Менопур бедеулікті емдеуге маманданған маманның бақылауымен ғана қолданылуы тиіс.
Емдеуді бастамас бұрын екі серіктестің де бедеулігі мен белсіздігінің себебіне зерттеу жүргізу, сондай-ақ ықтимал қарсы көрсетілімдерінің бар-жоқтығына қатысты медициналық зерттеу жүргізу қажет. Атап айтқанда, пациент әйелдерде гипотиреоидизмнің, адренокортикальді жеткіліксіздіктің, гиперпролактинемияның, гипофизарлық немесе гипоталамустық ісіктердің бар-жоқтығын зерттеу қажет, осы патологиялық жағдайларда қарастырылған тиісті емді тағайындау керек. Әйелдерде бедеулікті емдеуді бастар алдында аналық бездердің функциялық жағдайын (ультрадыбыстық диагностиканы және қандағы эстрадиол деңгейін) бағалаған жөн. Менопурдың алғашқы инъекциясы дәрігердің мұқият бақылауымен жүргізілуі тиіс. Фолликулдардың өсуіне стммуляция жүргізілетін пациенттерде аналық бездің ұлғаюы байқалуы немесе аналық бездің гиперстимуляциясы синдромы (АГС) дамуы мүмкін. Менопурды дозалаудың ұсынылған режимін сақтау және аналық бездің реакциясын мұқият бақылау осы жағымсыз әсерлердің даму қаупін барынша азайтуға жәрдемдеседі.
Аналық бездердің гиперстимуляциясы синдромы (АГС)
АГСС аналық бездердің асқынусыз ұлғаюынан айырмашылығы бар клиникалық құбылыс болып табылады және ауырлық дәрежесінің артуымен көрініс беруі мүмкін. АГСС белгілеріне мыналар жатады: аналық бездердің ұлғаюы, жыныс гормондарының сарысулық деңгейінің жоғары болуы және перитонеальді, плевральді сұйықтықтардың және, сирек жағдайларда перикардиальді қуыстарда сұйықтықтың жиналуына әкеп соғуы мүмкін қантамырлар өткізгіштігінің артуы.
АГСС ауыр жағдайларында мына симптомдар: абдоминальді ауыру, іштің ұлғаюы, аналық бездердің шамадан тыс ұлғаюы, дене салмағының артуы, ентігу, олигурия және жүректің айнуы, құсу және диарея сияқты асқазан-ішектің симптомдары байқалуы мүмкін. Клиникалық тексеру кезінде гиповолемия, қанның қоюлануы, электролиттік теңгерімнің бұзылуы, асцит, гемоперитонеум, плевралық жалқық, гидроторакс, өкпенің жедел жеткіліксіздігі және тромбоэмболия байқалуы мүмкін. Бұдан басқа, аналық бездердің кисталары жарылуы мүмкін.
Овуляцияға түрткі болуы үшін аХГ енгізілмейінше, гонадотропиндермен емдеуге шамадан тыс овариальді реакция АГСС-тің дамуына сирек ұрындырады. Демек, овариальді гиперстимуляция жағдайында аХГ енгізбеген жөн. Сонымен қатар пациент әйел кем дегенде 4 күн бойы жыныстық қатынасты тоқтата тұруға немесе контрацепцияның бөгеттік әдістерін пайдалануға кеңес беріледі. АГСС өте тез өршуі (24 сағаттан бастап бірнеше күнге дейін) және ауыр симптоматикаға ұшыратуы мүмкін. Демек, пациент әйел емдеудің алғашқы кезеңі ішінде және аХГ енгізгеннен кейін кем дегенде 2 апта бойы медициналық бақылауда болуы тиіс.
Ұсынылған дозаны және Менопур препаратын енгізу режимін сақтай отырып, сондай-ақ емдеу курсын мұқият қадағалай отырып, овариальді гиперстимуляцияның және көпұрықты жүктіліктің даму қаупін барынша азайтуға болады. ҚҰТ жүргізген кезде гиперстимуляцияның даму қаупін овуляция алдында фолликулдардың барлығын аспирациялау жолымен төмендетуге болады.
Аналық бездердің шамадан тыс реакциясын бағалау критерийлері:
Монофолликулярлы қозу жағдайында: плазмада эстрадиол деңгейінің 4000 пмол/л немесе 1100 пг/мл-ден көбірекке және/немесе диаметрі, ең кемінде, 16 мм болатын фолликулдың 3-тен көбірекке жоғарылауы.
Мультифолликулярлы стимуляция жағдайында: плазмада эстрадиол деңгейінің 11 нмол/л немесе 3000 пг/мл-ден көбірекке жоғарылауы және диаметрі, ең кемінде, 12 мм болатын 20 фолликулдың бар болуы.
Егер эстрадиол деңгейі 20 нмол/л немесе 5500 пг/мл-ден артық болса және, ең кемінде, 40 фолликул бар болса, аХГ енгізілмеуі тиіс.
Жүктілік басталған жағдайда АГСС өте ауыр болуы және ұзаққа созылуы мүмкін. Гормональді емдеу аяқталғаннан кейін АГСС өте жиі дамиды және емдеуді аяқтағаннан кейін шамамен 7-10 күннен соң ең жоғары жиілігіне жетеді. Әдетте АГСС етеккір басталған кезде өздігінен қайтады.
Ауыр АГСС жағдайында гонадотропиндермен емдеуді тоқтатқан жөн, егер ол әлі де жалғасатын болса, пациентті ауруханаға жатқызу және АГСС-ке тән спецификалық емді бастау керек.
Осы синдром поликистозды аналық без синдромы бар әйелдерде жиі кездеседі.
Көпұрықты жүктілік
Овуляцияны индукциялауға гонадотропиндер қолданылған пациенттерде көпұрықты жүктілік жиілігі, табиғи ұрықтандыруға қарағанда, жоғары болады. Көпұрықты жүктілік қаупін барынша азайту үшін әйелдің аналық бездерінің реакциясына мұқият бақылау жүргізу қажет.
ҚҰТ жүргізілетін пациенттерде көпұрықты жүктілік қаупі, негізінен, көшіріп салынған эмбриондар санына, олардың сапасы мен пациент әйелдің жас шамасына байланысты.
Жүктілікті аяғына дейін көтере алмау
Жүктілікті аяғына дейін көтере алмау фолликулдардың жетілуіне стимуляциялау жүргізілген әйелдерде немесе ҚҰТ бағдарламасын жүргізген кезде, табиғи ұрықтану жағдайларына қарағанда, жоғары болды.
Жатырдан тыс жүктілік
Жатыр түтікшелерінің аурулары бар әйелдерде, осы жүктіліктің табиғи ұрықтану немесе бедеулікті емдеу нәтижесінде басталғанына байланыссыз, жатырдан тыс жүктіліктің даму қаупі жоғары болады. ҚҰТ жүргізгеннен кейін, табиғи ұрықтанудағы 1-1,5% жағдайлармен салыстырғанда, жатырдан тыс жүктілік жағдайларының жиілігі 2-5%-ды құрады.
Ұрпақ өрбіту ағзаларының жаңа түзілімдері
Бедеулікке қатысты бірнеше рет дәрі-дәрмекпен ем қабылдаған әйелдерде, аналық бездер мен ұрпақ өрбіту жүйесінің басқа ағзаларының қатерсіз де, сонымен қатар қатерлі де жаңа түзілімдерінің дамуы байқалды, гонадотропинді қолданып емдеу мен жаңа түзілімдерге бейімділік арасында байланыс анықталған жоқ.
Туа біткен даму ақаулары
ҚҰТ жүргізгеннен кейін әйелдерде туа біткен даму ақауларының кең таралуы табиғи ұрықтану кезіндегі ақаулар санынан шамалы артық болуы мүмкін, бұл ата-аналарының жекелеген ерекшеліктерінің (анасының жас шамасы, шәуһет сипаты және т.б.) нәтижесі болуы мүмкін.
Тромбоэмболиялық асқынулар
Тромбоэмболиялық жағдайлардың даму қаупі жоғары болатын әйелдерде, тұқым қуалайтын бейімділік, семіздік (дене салмағының индексі > 30 кг/м2) немесе тромбофилия бар болғандықтан, гонадотропинмен емдеу кезінде де, сонымен қатар емдеу аяқталғаннан кейін де веналық немесе артериялық тромбоэмболиялық бұзылулар дамуы мүмкін. Жүктіліктің өз алдына тромбоэмболиялық асқынулар қаупін жоғарылататынын да айта кету керек.
Көлік құралын немесе қауіпті механизмдерді басқару қабілетіне ықпал ету ерекшеліктері
Ықпал етпейді.
Артық дозалануы
Симптомдары: аналық бездің гиперстимуляциясы синдромы (АГС) дамуы мүмкін.
Емі: АГС жеңіл дәрежесінде спецификалық ем қажет емес. Пациент әйел медициналық мұқият бақылауда болуы тиіс. АГС орташа дәрежесінде клиникалық мониторинг және симптоматикалық ем қолданылады, қажет болғанда вена ішіне гемоконцентрациясы жоғары қан алмастырғыштар енгізіледі. АГС ауыр дәрежеде болғанда міндетті түрде ауруханаға жатқызу қажет, өйткені мұндай жағдайларда қарқынды медициналық араласымды қажет ететін, өмірге қатер төндіретін жағдай дамуы мүмкін.
Шығарылу түрі және қаптамасы
Құрамында 600 ХБ/1200 ХБ фолликулостимуляциялаушы гормоны және 600 ХБ /1200 ХБ лютеиндеуші гормоны бар препарат түссіз шыны құтыға салынған.
1 мл еріткіш алдын ала толтырылған шприцте.
Ішінде препараты бар 1 құты және еріткіші бар 1 шприц, сұйылтуға арналған 1 ине ұяшықты пластик қаптамаға (мөлдір үлбірмен жабылған немесе пластик қақпағы бар) салынған. Енгізуге арналған 9 шприц және 9 спиртті сүрткі ұяшықты картон қаптамаға бөлек салынған және үлбірмен оралған. Ұяшықты пластик 1 қаптама және 1 ұяшықты картон қаптама медициналық қолдану жөнінде мемлекеттік және орыс тілдеріндегі нұсқаулықпен бірге картон қорапқа салынған (600 ХБ доза үшін).
Ішінде препараты бар 1 құты және еріткіші бар 2 шприц, сұйылтуға арналған 1 ине ұяшықты пластик қаптамаға (мөлдір үлбірмен жабылған немесе пластик қақпағы бар) салынған. Енгізуге арналған 18 шприц және 18 спиртті сүрткі ұяшықты картон қаптамаға бөлек салынған және үлбірмен оралған. Ұяшықты пластик 1 қаптама және 1 ұяшықты картон қаптама медициналық қолдану жөнінде мемлекеттік және орыс тілдеріндегі нұсқаулықпен бірге картон қорапқа салынған (1200 ХБ доза үшін).
Сақтау шарттары
Түпнұсқалық қаптамасында, 2-ден 8°С-ге дейінгі температурада сақтау керек. Мұздатып қатыруға болмайды.
Сұйылтылған препаратты 25 °С-ден аспайтын температурада 28 күн бойы сақтауға болады.
Балалардың қолы жетпейтін жерде сақтау керек!
Сақтау мерзімі
3 жыл
Жарамдылық мерзімі өткеннен кейін қолдануға болмайды.
Дәріханалардан босатылу шарттары
Рецепт арқылы
Өндіруші
«Ферринг ГмбХ», Германия
Wittland 11, 24109 Kiel, Germany
Тіркеу куәлігінің ұстаушысы және қаптаушы
«Ферринг Интернешнл Сентер СА», Швейцария
Chemin de la Vergognausaz 50,1162 St-Prex,Switzerland
Қазақстан Республикасы аумағында тұтынушылардан дәрілік заттың сапасына қатысты шағымдарды (ұсыныстарды) және Қазақстан Республикасы аумағында дәрілік заттың тіркеуден кейінгі қауіпсіздігін қадағалауға жауапты ұйымның мекенжайы
Қазақстан Республикасындағы «Ферринг Фармацевтикалс С.А.» өкілдігі
Қазақстан Республикасы, Алматы қ., 050022, Алмалы ауданы, Наурызбай батыр к-сі, 99/1 үй, 41б кеңсе
Тел./факс: +7(727) 311-54-47
РЕКОВЕЛЛЬ (фоллитропин дельта)
Қазақстан Республикасы
Денсаулық сақтау министрлігі
Фармация комитеті төрағасының
201_ жылғы “____” ___________
№ _____ бұйрығымен
БЕКІТІЛГЕН
Дәрілік затты медициналық қолдану жөніндегі нұсқаулық
Рековелль
Осы дәрілік препарат қосымша мониторингке жатады. Бұл қауіпсіздігі бойынша жаңа ақпаратты анықтауға мүмкіндік береді. Біз денсаулық сақтау жүйесінің қызметкерлерінен кез келген күдік туғызған жағымсыз реакциялар жөнінде хабарлауды сұраймыз.
Саудалық атауы
Рековелль
Халықаралық патенттелмеген атауы
Фоллитропин дельта
Дәрілік түрі
Инъекцияға арналған ерітінді, 12 мкг/0.36 мл, 36 мкг/1.08 мл және 72 мкг/2.16 мл
Құрамы
Ерітіндісі бар1 картридждің ішінде
белсенді зат- фоллитропин дельта (рекомбинантты) 12,0 мкг, 36,0 мкг немесе 72,0 мкг;
қосымша заттар: фенол, полисорбат-20, L-метионин, натрий сульфат декагидраты, динатрий гидрофосфат додекагидраты, фосфор қышқылы, натрий гидроксиді, инъекцияға арналған су
Сипаттамасы
Көрінетін механикалық қосындыларсыз, мөлдір түссіз ерітінді.
Фармакотерапиялық тобы
Жыныстық гормондар және жыныс жүйесінің модуляторлары. Гонадотропиндер және басқа овуляция стимуляторлары.
Гонадотропиндер. Фоллитропин дельта.
АТХ коды G03GА10
Фармакологиялық қасиеттері
Фармакокинетикасы
Сіңуі күн сайын тері астына енгізген кезде фоллитропин дельта ең жоғары концентрациясына шамамен 10 сағаттан кейін жетеді. Абсолютті биожетімділігі 64% жуықты құрайды.
Таралуы тері астына енгізуден кейін болжамды таралу көлемі 25 л жуықты, ал вена ішіне енгізген кезде таралу көлемі 9 л (тепе-тең концентрацияға жеткенде) құрайды. Емдік диапазонда фоллитропин дельтаның жүйелі әсерінің айқындығы препараттың енгізілген дозасына тура пропорционал.
Шығарылуы фоллитропин дельта, басқа да фоллитропиндер сияқты, негізінен бүйрекпен шығарылады деп болжанады. Өзгермеген күйде несеппен әсер етуші заттың 9% жуығы шығарылады. Фоллитропин дельтаны тері астына бір рет енгізген кезде жартылай шығарылу кезеңі 40 сағатқа жуықты, одан кейінгі тері астына енгізулерде – 28 сағатқа жуықты құрайды. Тері астына енгізген кезде препараттың болжамды клиренсі 0,6 л/сағ, ал вена ішіне енгізген кезде – 0,3 л/сағ құрайды. Препаратты одан әрі енгізулер кезіндегі айқын жүйелі әсеріне байланысты жоғары тиімділікке әкелетін, 0,6 л/сағ жуық, төмен болжамды клиренсі байқалады.
Фармакодинамикасы
Рековелль – адамның рекомбинантты фолликул стимуляциялау гормоны (ФСГ), фолликулдардың өсуі мен дамуын стимуляциялайтын препарат болып табылады. ФСГ парентеральді енгізгенде көптеген жетілген фолликулдардың түзілуі байқалады. Фоллитропиннің екі субъбірлігінің амин қышқылдарының бірізділігі адамның эндогендік ФСГ амин қышқылдарының бірізділігімен бірдей. Фоллитропин дельта синтезі PER. C6 желісіндегі адам жасушаларын пайдаланумен жүзеге асады, сондықтан гликозилдену бейіні фоллитропин альфа мен фоллитропин бетадан өзгеше.
Егеуқұйрықтарда in vivo Steelman-Pohley тестін жүргізген кезде әсер ету бірліктерімен (ХБ) айқындалатын баламалы дозаларда пайдаланылған Рековелль препаратын және фоллитропин альфаны күн сайын енгізгенде, аналық бездердің неғұрлым айқын жауабы Рековелль препаратын қабылдаған дарақтарда байқалды (аналық бездердің жауабы эстрадиол концентрациясы, ингибин В және фолликулдардың өлшемі бойынша бағаланды). Аталған тест препараттың биологиялық белсенділігін толық бағалауға мүмкіндік бермейтіндіктен, Рековелль препаратының дозасы әсер ету бірліктерімен (ХБ) емес, микрограмдармен келтіріледі.
Рековелль препаратының дозасын және қан сарысуындағы антимюллер гормонының (АМГ) концентрациясын арттырған кезде жетілген фолликулдар саны ұлғаяды. Керісінше, дене салмағы үлкен болғанда жетілген фолликулдар саны азаяды (фоллитропин дельтаны 12 мкг-ден төмен дозада қолданған кезде ғана клиникалық маңызы бар).
Қолданылуы
Мынадай қосымша ұрпақ өрбіту технологиясын (ҚҰТ): экстракорпоральді ұрықтандыруды (ЭКҰ) немесе шәуһеттің интрацитоплазмалық инъекциясын (ИКСИ) жүргізу кезінде көптеген фолликулдардың өсуін индукциялау мақсатында аналық бездердің бақыланатын гиперстимуляциясында.
Қолдану тәсілі және дозалары
Рековелль препаратымен емдеуді тиісті мамандығы және бедеулікті емдеуде тәжірибесі бар дәрігердің бақылауымен ғана жүргізу керек. Препараттың дозасы микрограмдармен көрсетіледі. Таңдап алынған емдеу сызбасы жеке болып табылады және басқа гонадотропиндермен емдеу кезінде пайдалануға болмайды.
Емнің бірінші циклінде препараттың тәуліктік дозасы қан сарысуындағы антимюллер гормонының (АМГ) концентрациясы пациент әйелдің дене салмағы негізінде анықталады. Дозаны таңдаған кезде АМГ соңғы (алдыңғы 12 айдағы) мәнін негізге алу қажет. Емдеудің бірінші циклі бойында препараттың дозасы өзгертілмеуі тиіс.
АМГ деңгейі < 15 пмоль/л болатын әйелдерде дене салмағына қарамастан тәуліктік доза 12 мкг құрайды. АМГ концентрациясы ≥ 15 пмоль/л болғанда фоллитропин дельтаның тәуліктік дозасы АМГ концентрациясын ескере отырып дене салмағына 0,10 – 0,19 мкг/кг диапазонында ауытқиды (1-кестені қараңыз). Препараттың есептелген дозасы сәйкес болуы үшін шприц-қаламдағы шкалада дозаны жуық деген 0,33 мкг дейін дөңгелектеуге болады. Емдеудің бірінші циклінде препараттың жоғары тәуліктік дозасы 12 мкг құрайды.
Рековелль препаратының дозасын анықтау үшін пациент әйелдің дене салмағын (аяқ киімсіз және сырт киімсіз) емдеу циклі тікелей басталар алдында өлшеу қажет.
1-кесте
Дозалау режимі
|
АМГ, пмоль/л |
< 15 |
15-16 |
17 |
18 |
19-20 |
21-22 |
23-24 |
25-27 |
28-32 |
33-39 |
≥ 40 |
|
Тәулік-тік доза |
12 мкг |
0,19 мкг/кг |
0,18 мкг/кг |
0,17 мкг/кг |
0,16 мкг/кг |
0,15 мкг/кг |
0,14 мкг/кг |
0,13 мкг/кг |
0,12 мкг/кг |
0,11 мкг/кг |
0,10 мкг/кг |
АМГ концентрациясы пмоль/л-мен көрсетіледі және бүтін санға дейін дөңгелектенеді. Егер АМГ мәні нг/мл-мен ұсынылса, 7,14-ке көбейту арқылы өлшем бірліктерін пмоль/л-ге өзгерту қажет (нг/мл х 7,14 = пмоль/л).
Рековелль препаратымен емді етеккір оралымының 2 немесе 3 күндерінде бастайды және фолликулдардың қажетті саны (диаметрі ≥ 17 мм болатын ≥ 3 фолликул) пайда болғанға дейін жалғастырады, және, әдетте, нәтижеге емнің 9-шы күніне қарай қол жеткізіледі (емнің ұзақтығы 5-20 күн). Овуляция индукциясы үшін пациент әйелге адамның хориондық гонадотропинін (аХГ) бір рет енгізу қажет, рекомбинантты, 250 мкг, немесе 5000 ХБ аХГ. Егер пациент әйелде фолликулдардың көп мөлшері (диаметрі ≥ 12 мм болатын > 25 фолликул) қалыптасқаны байқалса, Рековелль препаратымен емді тоқтату қажет, бұл жағдайда овуляцияның индукциясы жүргізілмейді.
Емнің қосымша циклдері қажет болғанда Рековелль препаратының тәуліктік дозасы аналық бездердің алдыңғы циклдегі реакциясының айқындығына байланысты сақталуы немесе түзетілуі мүмкін. Егер аналық бездердің алдыңғы циклдегі реакциясының айқындығы қанағаттанарлық, АБГС дамуынсыз болса, препаратты сондай дозада пайдалану керек. Аналық бездердің алдыңғы циклдегі реакциясының айқындығы жеткіліксіз болған жағдайда, препараттың дозасын 25 %-ға немесе 50 %-ға, пациенттің емдеуге жауабына байланысты арттыру керек. Егер алдыңғы етеккір оралымында аналық бездердің шамадан тыс жауабы байқалса, препараттың дозасын 20 %-ға немесе 33 %-ға, емдеуге жауаптың айқындығына байланысты төмендету қажет. Алдыңғы циклде АБГС дамыған жағдайда немесе АБГС пайда болу қаупі болғанда тәуліктік дозаны келесі циклде 33 %-ға азайту қажет. Препараттың ең жоғары тәуліктік дозасы 24 мкг.
Рековелль препараты тері астына енгізуге арналған, алдыңғы құрсақ қабырғасы аумағы қолайлырақ. Препараттың алғашқы инъекциясын медицина қызметкерінің тікелей бақылауымен жүргізу керек. Препараттың күн сайынғы бір реттік инъекцияларын, инъекция аймағын күнде өзгерте отырып, белгіленген бір уақытта жүргізген жөн. Препаратты өз бетінше енгізуді тиісті түрде үйретілген пациенттер ғана жүргізуіне болады, қажет болған жағдайда олардың дәрігерден кеңес алуға мүмкіндігі бар.
Ерекше клиникалық жағдайларда қолдану
Бүйрек және бауыр функциясының бұзылуы
Препаратты бауыр және/немесе бүйрек функциясы бұзылған пациенттерде қолданудың фармакокинетикасына, тиімділігі мен қауіпсіздігіне баға берілген жоқ. Препаратты дозалау режимін түзету қажеттілігі туралы ақпарат жоқ.
Поликистозды аналық бездер синдромына (ПКАС) байланысты ановуляция
ПКАС байланысты ановуляциясы бар пациент әйелдерде Рековелль препаратын қолдану зерттелмеген. Препараттың клиникалық зерттеулері поликистозды аналық бездер синдромы бар етеккір оралымы бұзылмаған әйелдерде жүргізілген.
Егде жастағы пациенттер
Препарат көрсетілімнің болмауына байланысты егде жастағы пациенттерде қолданылмайды.
Жағымсыз әсерлері
Жиі (≥ 1/100 - <1/10 дейін)
бас ауыру
жүрек айну
жамбас аймағының ауыруы, жатыр қосалқылары аймағының ауыруы, жамбас аймағындағы жайсыздық, аналық бездердің гиперстимуляция синдром синдром (АБГС)
қатты қажу
Емдеудің қайталанған цикллерінде жоғарыда аталған реакциялардың пайда болу жиілігі төмендейді.
Жиі емес (≥ 1/1000 - <1/100 дейін)
көңіл-күй құбылмалылығы
ұйқышылдық, бас айналу
абдоминальді жайсыздық, диарея, құсу, іш қату
қынаптан қан кету, сүт бездеріндегі жайсыздық (сүт бездерінің сезімталдығы, ауыруы және ұлғаюы).
Аналық бездердің бақыланатын гиперстимуляциясын жүргізу АБГС дамуының жоғары қаупімен байланысты. АБГС кезінде сирек жағдайда аналық бездің бұралып қалуы және тромбоэмболиялық асқынулар дамиды.
Гонадотропиндерді қабылдаған кезде ФСГ-ге антиденелер түзілуімен иммуногенділіктің дамуы мүмкін.
Қолдануға болмайтын жағдайлар
Дәрілермен өзара әрекеттесуі
Рековелль препаратының дәрілік өзара әрекеттесулеріне зерттеулер жүргізілмеген. Рековелль препаратымен ем барысында басқа дәрілік препараттармен клиникалық маңызды өзара әрекеттесулері туралы хабарланған жоқ.
Айрықша нұсқаулар
Рековелль препаратының айқын гонадотроптық белсенділігі бар, осыған байланысты препаратты қабылдаған кезде жеңілден ауырға дейінгі ауырлық дәрежесіндегі жағымсыз реакциялар дамуы мүмкін. Ем бедеулікті диагностикалау және емдеу тәжірибесі бар дәрігердің бақылауымен жүргізілуі тиіс!
Гонадотропиндерді қолдану білікті медициналық қызметкерлердің, сондай-ақ тиісті құрал-жабдықтардың болуын қажет етеді. Рековелль препаратын тағайындар алдында және емдеу барысында аналық бездердің жай-күйін бақылау керек. Препаратты емдеу мақсаттарына жауап беретін жекелей таңдап алынған дозада қолдану қажет. Фоллитропин дельтаны қабылдауға жауаптың айқындығы әртүрлі пациент әйелдерде төменнен шамадан тысқа дейін ауытқиды.
Рековелль препаратымен емдеу сызбасы аналық бездердің жауабына, жетілген фолликулдардың жеткілікті санын алуға және аналық бездердің гиперстимуляция синдромының (АБГС) пайда болу жиілігін азайтуға қол жеткізу үшін жекелей таңдап алынады. Препараттың дозасы микрограмдармен көрсетіледі. Таңдап алынған емдеу сызбасы жеке болып табылады және басқа гонадотропиндермен емдеу кезінде пайдалануға болмайды.
Рековелль препаратын қолданар алдында бедеуліктің әйелдегі де, оның серіктесіндегі де себептеріне диагностика жүргізу, сондай-ақ жүктілікке деген ықтимал қарсы көрсетілімдерді анықтау ұсынылады. Емдеуді бастар алдында әйелдерде гипотиреоздың және гиперпролактинемиияның бар-жоғына тексеру жүргізу керек, қажет болса тиісті ем тағайындалады.
Фолликулдар өсуінің бақыланатын стимуляциясын жүргізу аналық бездердің гиперстимуляциясының дамуымен бірге олардың ұлғаюына әкелуі мүмкін. Жүргізілетін емге мониторингпен үйлестіре дозалау режимін сақтаған кезде жоғарыда аталған реакциялардың пайда болу қаупін барынша азайтуға болады.
Аналық бездердің гиперстимуляция синдромы(АБГС)
Бақыланатын гиперстимуляция кезінде аналық бездердің ұлғаюы мүмкін. Мұндай реакция поликистозды аналық бездер синдромы бар пациент әйелдерге көбірек тән болады және көпшілігінде қосымша емдеусіз, өздігінен басылады.
АБГС – аналық бездердің асқынбаған ұлғаюынан өзгешеленетін синдром, оның көрініс беруі ауырлық дәрежесіне байланысты. Ол аналық бездердің елеулі ұлғаюын, қан плазмасындағы эстрогендердің жоғары концентрациясын, сондай-ақ тамырлардың өткізгіштігінің артуын қамтиды, бұл құрсақ, плевралық және, сиректеу, перикардиальді қуыста сұйықтықтың жинақтауына әкелуі мүмкін.
АБГС даму қаупін төмендету үшін фолликулдардың жетілуіне мұқият әрі жиі мониторинг жүргізу қажет. Ауыр АБГС жағдайларында мынадай симптомдар болуы мүмкін: іштің ауыруы, іштің кебуі, аналық бездердің елеулі ұлғаюы, дене салмағының артуы, ентігу, олигурия және жүрек айнуын, құсуды және диареяны қоса, асқазан-ішек симптомдары. Клиникалық тексеру кезінде гиповолемия, гемоконцентрация, электролиттік бұзылыстар, асцит, гемоперитонеум, экссудативті плеврит, гидроторакс, жедел респираторлық дистресс-синдром анықталуы мүмкін. Өте сирек жағдайда ауыр АБГС аналық бездің бұралып қалуымен немесе өкпе артериясының тромбоэмболиясы, ишемиялық инсульт немесе миокард инфарктісі сияқты тромбоэмболиялық асқынулармен нашарлауы мүмкін.
Егер овуляцияны стимуляциялау мақсатында аХГ енгізілмесе, гонадотропиндерді енгізуге аналық бездердің шамадан тыс реакциясы АБГС дамуына сирек әкеліп соғады. АБГС жүктіліктің дамуы кезінде неғұрлым ауыр әрі ұзақ болуы мүмкін. Сондықтан аналық бездердің гиперстимуляциясы жағдайында аХГ енгізбеу керек, ал пациент әйелге кемінде 4 күн бойы жыныстық қатынастардан бас тарту немесе контрацепцияның бөгеттік әдістерін пайдалану қажет екенін ескерту керек. АБГС жылдам үдеп (24 сағаттан бірнеше күнге дейінгі уақытта), күрделі медициналық асқынуға айналуы мүмкін. АБГС гормональді ем аяқталғаннан кейін жиірек дамиды, АБГС кеш дамуы жүктілік кезіндегі гормональді өзгерістердің салдары болуы мүмкін. Сондықтан пациент әйелдерді, кем дегенде, фолликулдар толық жетілгеннен кейін 2 аптадан кем емес уақыт бойы мұқият бақылау қажет.
Тромбоэмболиялық асқынулар
Таяуда диагностикаланған немесе емделу сәтінде тромбоэмболиялық аурулары бар әйелдерде немесе жеке немесе отбасылық бейімділік, семіздік (ДСИ > 30 кг/м2) немесе тромбофилия сияқты тромбоэмболиялық асқынулар дамуының белгілі қауіп факторлары бар әйелдерде гонадотропиндермен емдеу кезінде немесе емдеуден кейін веналық немесе артериялық тромбоэмболиялық асқынулардың қаупі жоғары болуы мүмкін. Мұндай жағдайларда оларды қолданудың пайдасы ықтимал қаупімен салыстырылуы тиіс. Жүктіліктің өзі де тромбоэмболиялық асқынулардың даму қаупін жоғарылататынын ескерген жөн.
Аналық бездің бұралып қалуы
ҚРТ жүргізген кезде аналық бездің бұралып қалу жағдайлары сипатталған. Аналық бездің бұралып қалу себебі АБГС, жүктілік, құрсақ қуысында бұрын жүргізілген хирургиялық араласымдар, аналық бездің бұралып қалуы, аналық без кистасы немесе анамнездегі ПКАБС болуы мүмкін. Қанның ағып келуінің бұзылуы салдарынан аналық бездің зақымданулары дер кезінде диагностикаланғанда және аналық бездің шұғыл деторсиясын жүргізгенде азаюы мүмкін.
Көп ұрықты жүктілік
Көп ұрықты жүктілікте анаға және перинатальді нәтижелерге қолайсыздық қаупінің жоғарылауы байқалады.
ҚРТ жүргізген жағдайда көп ұрықты жүктіліктің пайда болу ықтималдығы енгізілген эмбриондардың санына, сапасына және пациент әйелдің жасына байланысты. Сирек жағдайларда бір эмбрионды енгізген кездің өзінде егіздерге жүкті болу жағдайлары байқалған.
Пациент әйелге көп ұрықты жүктіліктің әлеуетті қаупі туралы емдеу басталғанға дейін ескертілуі тиіс.
Жүктіліктің асқынулары
ҚРТ бағдарламасы шеңберінде аналық бездердің бақыланатын стимуляциясы жүргізілетін пациент әйелдерде жүктілік кезінде өздігінен түсік тастау (шарананың жатыр ішінде өлуі) жиілігі дені сау әйелдердегіден жоғары.
Эктопиялық жүктілік
Анамнезінде жатыр түтіктерінің аурулары бар пациент әйелдерде, табиғи ұрықтануда да, бедеулікті емдеу кезінде де, эктопиялық жүктіліктің пайда болу қаупі жоғары болады. ҚРТ-дан кейін жатырдан тыс жүктіліктің таралуы жалпы популяциямен салыстырғанда жоғары.
Ұрпақ өрбіту жүйесі ағзаларының жаңа түзілімдері
Бедеулікті емдеуге арналған препараттарды енгізудің бірнеше сызбаларынан өткен әйелдерде аналық бездердің және басқа да ұрпақ өрбіту ағзаларының қатерсіз де, қатерлі де жаңа түзілімдері туралы хабарламалар бар. Қазіргі уақытта гонадотропиндермен емдеу бедеу әйелдердегі осындай ісіктердің бастапқы қаупін ұлғайтатыны анықталған жоқ.
Дамудың туа біткен ақаулары
ҚРТ пайдалану кезінде дамудың туа біткен ақауларының таралуы табиғи ұрықтану кезіндегіге қарағанда аздап жоғарылау. Бұл ата-аналардың жеке ерекшеліктеріне (анасының жасына, шәуһеттің сипаттамаларына) және көп ұрықты жүктілікке байланысты болуы мүмкін деп саналады.
Бауыр және бүйрек функциясының бұзылуы
Препаратты бауыр немесе бүйрек функциясының ауырлығы орташа немесе ауыр дәрежедегі бұзылулары бар пациенттерде қолдану туралы ақпарат жоқ.
Натрий мөлшері
Рековелль препаратының құрамында натрий іс жүзінде жоқ (дозаға 1 ммоль-ден аз (23 мг) натрий).
Дәрілік заттың көлік құралын немесе қауіптілігі зор механизмдерді басқару қабілетіне ықпал ету ерекшеліктері
Фоллитропин дельтаның көлік құралдарын және механизмдерді басқару қабілетіне ықпал етуіне зерттеулер жүргізілмеген. Рековелль препаратының көлік құралдарын және басқа механизмдерді басқару қабілетіне теріс ықпал ету ықтималдығы аз.
Артық дозалануы
Рековелль препаратын қабылдау кезіндегі артық дозалану жағдайлары белгісіз, алайда мұндай жағдайларда аналық бездердің гиперстимуляция синдромының (АБГС) дамуы байқалуы мүмкін.
Толығырақ “Айрықша нұсқаулар” бөлімінен қараңыз.
Шығарылу түрі және қаптамасы
Тері астына енгізуге арналған инъекцияға арналған ерітінді алдын ала толтырылған шприц-қаламмдарда, 12 мкг/0.36 мл, 36 мкг/1.08 мл, 72 мкг/2.16 мл
0.36 мл немесе 1.08 мл, немесе 2.16 мл препараттан І типті түссіз шыныдан жасалған, көлемі 3 мл картриджде. Картридж көп реттік инъекцияларға арналған пластик мультидозалық бір реттік шприц-қаламға орнатылған.
1 мультидозалық көп реттік инъекцияларға арналған бір реттік пластик шприц-қаламнан және инъекцияға арналған 3 инеден (12 мкг/0.36 мл дозалануы үшін) немесе 1 мультидозалық көп реттік инъекцияларға арналған бір реттік пластик шприц-қаламнан және инъекцияға арналған 6 инеден (36 мкг/1.08 мл дозалануы үшін), 1 мультидозалық көп реттік инъекцияларға арналған бір реттік пластик шприц-қаламнан және инъекцияға арналған 9 инеден (72 мкг/2.16 мл дозалануы үшін) медициналық қолдану жөніндегі мемлекеттік және орыс тілдеріндегі нұсқаулықпен бірге картон қаптамаға салынады.
Сақтау шарттары
Түпнұсқалық қаптамасында, 2 оС-ден 8 оС дейінгі температурада, жарықтан қорғалған жерде сақтау керек. Мұздатып қатыруға болмайды.
Бірінші қолданғаннан кейін препаратты 25 ºС дейінгі температурада, қайтадан салқындатусыз 28 тәуліктен асырмай сақтауға болады. Картридж шприц-қаламда қалуы тиіс. Көрсетілген мерзімнен кейін препарат жойылуы керек.
Балалардың қолы жетпейтін жерде сақтау керек.
Сақтау мерзімі
3 жыл.
Жарамдылық мерзімі өткеннен кейін қолдануға болмайды.
Босатылу шарттары
Рецепт арқылы
Өндіруші
Vetter Pharma-Fertigung GmbH & Co. KG, Германия
Schutzenstrasse 87, und 99-101, 88212 Ravensburg, Germany
Тіркеу куәлігінің ұстаушысының атауы және елі
Ferring Pharmaceuticals A/S, Дания
Kay Fiskers Plads 11, 2300 Copenhagen S, Denmark
Қаптаушы:
Ferring Controlled Therapeutics Limited, Ұлыбритания
1 Redwood Place, Peel Park Campus, East Kilbride, Glasgow, G74 5 PB, UK
Қазақстан Республикасы аумағында тұтынушылардан дәрілік заттардың сапасына қатысты шағымдарды (ұсыныстарды) қабылдайтын және дәрілік заттың тіркеуден кейінгі қауіпсіздігін қадағалауға жауапты ұйымның атауы, мекенжайы және байланыс деректері (телефон, факс, электронды пошта)
«Ферринг Фармацевтикалс СА» Қазақстан Республикасындағы өкілдігі
Қазақстан Республикасы
Алматы қ., 050022, Наурызбай батыр к-сі, 99/1 үй, т.е.ү. 41Б
Тел.\факс: (727) 311-54–47
ПРЕПАРАТТЫ ӨЗ БЕТІНШЕ ЕНГІЗУ КЕЗІНДЕГІ НҰСҚАУЛАР
Рековелль препараты бар алдын ала толтырылған шприц-қалам:
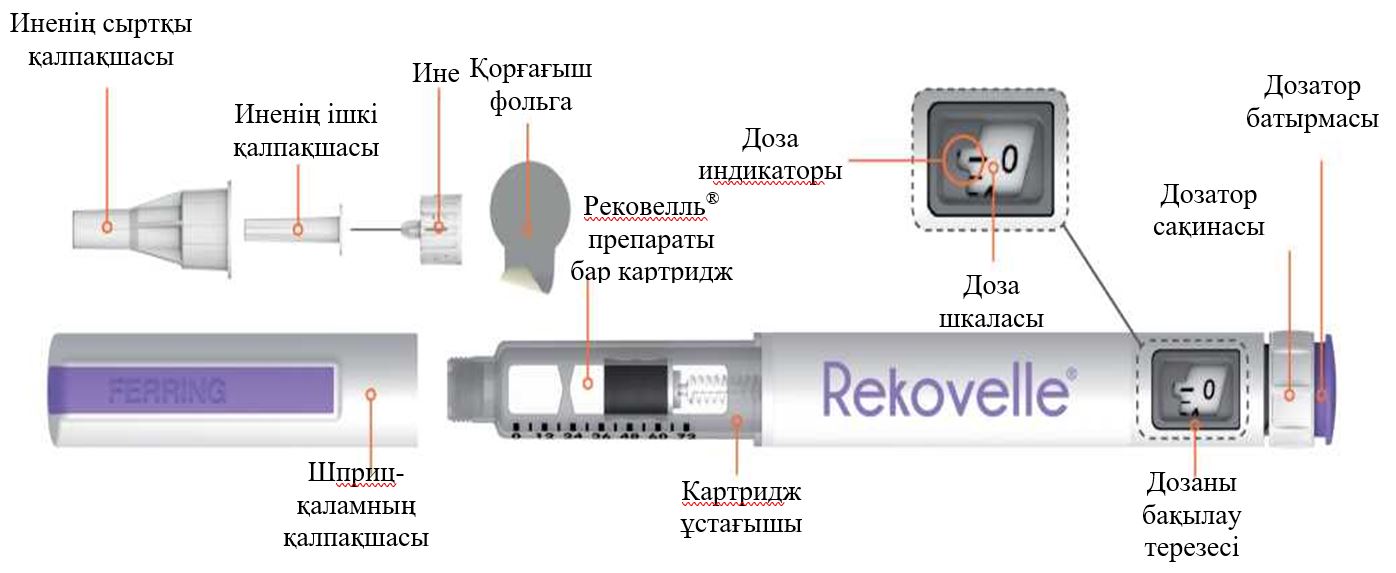
Егер пациент өз бетінше Рековелль енгізетін болса, ол төменде берілген нұсқаулықтармен мұқият танысуы және оларды қадағалауы қажет:
Жалпы нұсқаулар
Препарат тері астына енгізуге арналған. Препараттың алғашқы инъекциясын медициналық қызметкердің тікелей бақылауымен жасау керек.
Препараттың күнделікті инъекцияларын, инъекция салатын жерді күн сайын ауыстырып, белгілі бір уақытта жасау ұсынылады.
Препаратты өз бетінше енгізуді тиісінше үйретілген, қажет болған жағдайда, дәрігермен кеңесу мүмкіндігі бар пациенттер ғана атқара алады.
Алдын ала толтырылған шприц-қаламдар тек бір пациенттің пайдалануына арналған.
Қолданар алдында және шприц-қаламды әрбір ауыстыру кезінде берілген ақпаратпен мұқият танысыңыз, өйткені дұрыс пайдаланбау тағайындалғанынан басқа дозаны енгізуге әкеліп соғуы мүмкін.
Рековелль препараты бар алдын ала толтырылған шприц-қаламды дайындау және препараттың тағайындалған дозасын төменде сипатталғандай енгізу қажет. Дозаны бақылау терезесінен көрінетін сандар дозаны микрограмдармен немесе мкг көрсетеді.
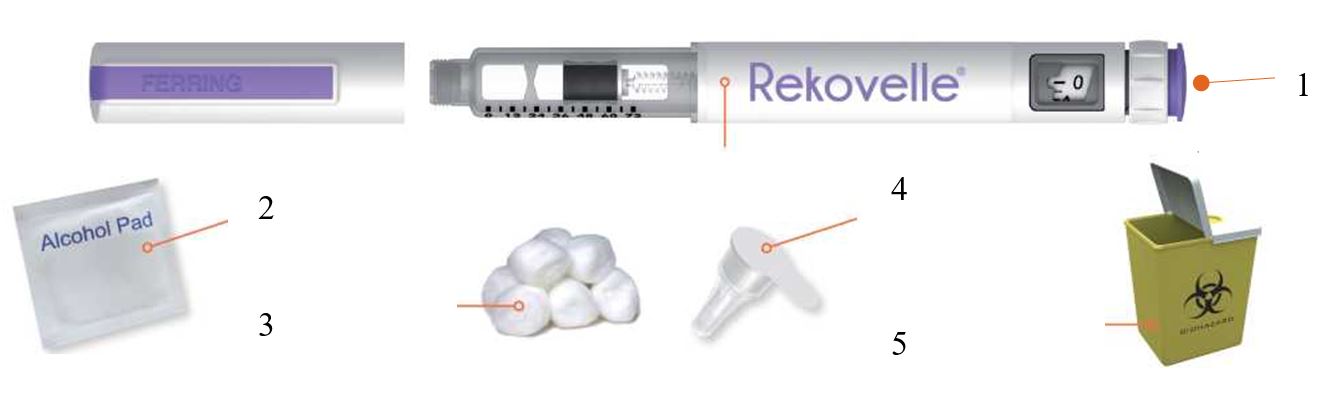
1 –Рековелль препараты бар алдын ала толтырылған шприц-қалам;
2 – спирт сіңірілген тампон;
3 – стерильді дәке / мақталы тампон;
4 – алмалы-салмалы ине;
5 – өткір заттарға арналған контейнер.
2.1. Шприц-қаламның қалпақшасын шешіңіз.
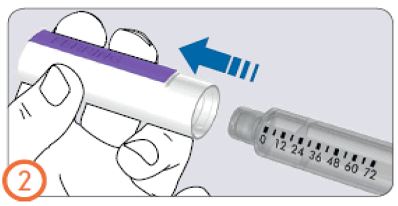
2.2. Бақылау терезесінде «0» қойылғанын тексеріңіз.
2.3. Инені инъекцияға дайындаңыз.
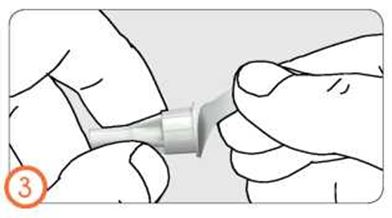
2.4. Инені жалғаңыз.
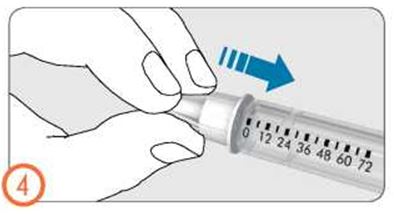
Сыртқы қалпақшаны қоя тұрыңыз – ол кейінірек керек болады.
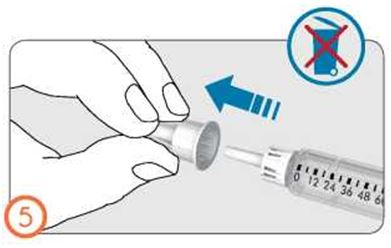
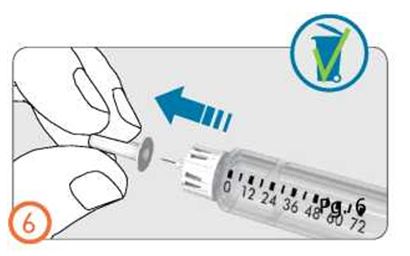
2.5. Иненің ұшындағы сұйықтықтың мөлшерін мұқият зерттеңіз, шприц-қалам препараттың аздаған артық мөлшерімен әдейі толтырылған.
Сақтандыру: жүйеден ауаны шығару үшін тамшылардың бар-жоғын Рековелль препараты бар шприц-қаламын алғаш пайдаланғанда ғана тексеріңіз.
Егер Сіз жаңа қаламды бірінші пайдаланғанда ұсақ сұйықтық тамшыларын көрмесеңіз:
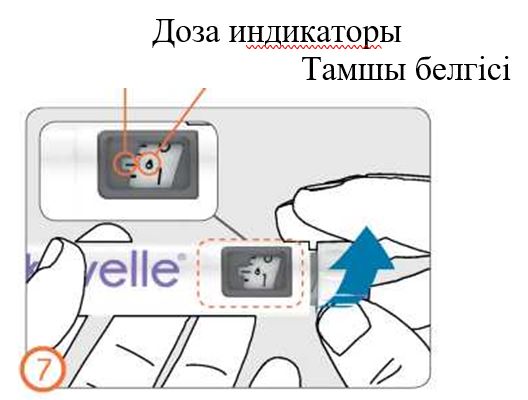
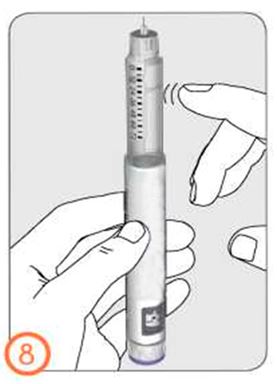
Сұйықтық тамшысы
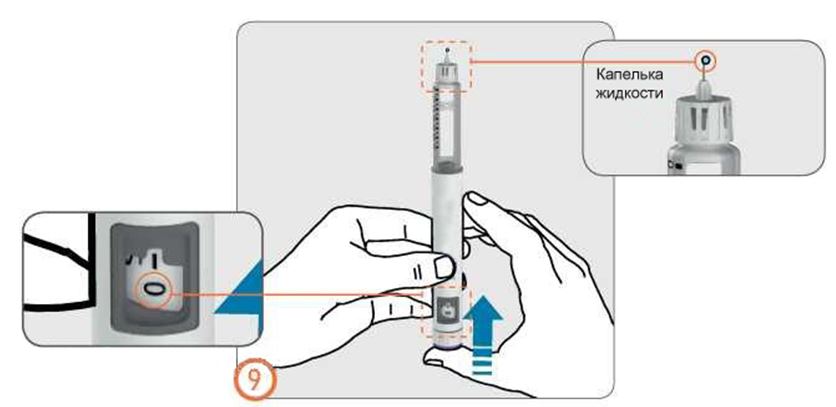
3.1. Шприц-қаламда 12 мкг/ 0,36 мл, 36 мкг/ 1,08 мл немесе 72 мкг/ 2,16 мл фоллитропин дельта бар.
Алдын ала толтырылған шприц-қалам 0,33 мкг-ден 20 мкг дейінгі дозаларды 0,33 мкг қадаммен енгізуге лайықталған болуы мүмкін. Қаламның дозалар шкаласы 0-ден 20 мкг дейін таңбаланған. Әрбір сан екі сызықпен бөлінген, әрбір сызық бір қадамға (0,33 мкг) сәйкес келеді. Дозаны белгілеуге арналған сақина бұралғанда өзіне тән сыртыл қатар естіледі, доза әр ұлғайтылған сайын сақинаның кедергісі сезіледі; жоғарыда айтылғандардың бәрі дұрыс дозаны алуға көмектеседі.
3.2. Дозатор сақинасын қажетті доза пайда болғанша бұраңыз.
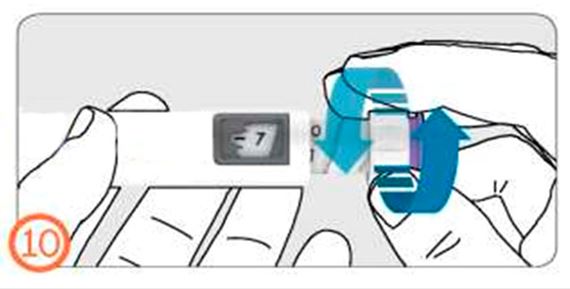
Сақтандыру: Келесі сатыға ауысар алдында дозаны бақылау терезесінде толық тағайындалған дозаның көрсетілгенін тексеріңіз.
4.1. Рековелль препараты алдыңғы құрсақ қабырғасы аумағына енгізіледі. Тері реакцияларын барынша азайту үшін, инъекция жасауға күн сайын әртүрлі орындарды таңдаңыз. Препаратты зақымдануы бар (саусақпен басқанда ауыратын), соғылған, қызарған, тығызданған және жарақаттары бар аймақтарға енгізбеген жөн.
4.2. Инъекцияға арналған жерді спирт сіңірілген тампонмен сүртіңіз.
4.3. Терезеде көрсетілген дозаның дұрыс екенін тағы бір рет тексеріңіз.
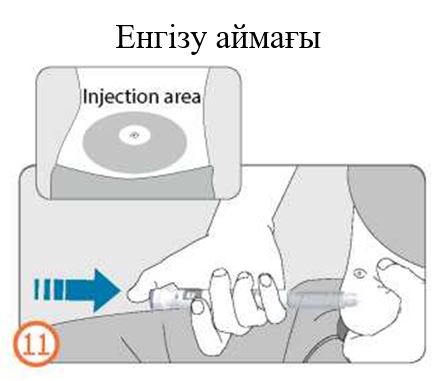
Сақтандыру: Егер дозатордың батырмасын басу қиын болса, күш қолданбаңыз – инені ауыстыру керек. Егер инені ауыстырғаннан кейін дозатордың батырмасын басу жеңілдемесе, жаңа шприц-қаламды пайдаланыңыз.
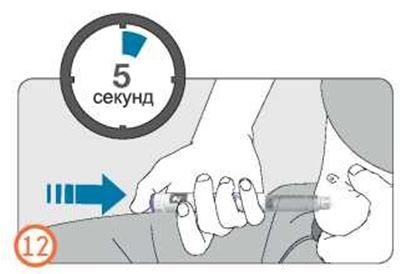
Сақтандыру: Препаратты енгізген кезде шприц-қаламды қисайтпаңыз, бұл иненің майысуына немесе сынуына әкелуі мүмкін. Егер енгізгеннен кейін ине сынып және сынығы тері астында қалып қойса, дереу медициналық көмекке жүгініңіз.
5.1. Сіздің толық доза енгізгеніңізді тексеріңіз.
Дозаны бақылау терезесінде «0» көрсетілгенін тексеріңіз.
Сақтандыру: Егер дозаны бақылау терезесінде 0-ден үлкен сан көрінсе, бұл Рековелль препараты бар шприц-қаламның бос екенін және Сіздің препараттың дозасын толық енгізбегеніңізді білдіреді.
5.2. Толық емес инъекцияны аяқтау (қажет болған жағдайларда ғана).
Сақтандыру: Бөлек енгізген кезде бос шприц-қаламды ғана тастай салыңыз.
5.3. Әр инъекциядан кейін инені алып тастау.
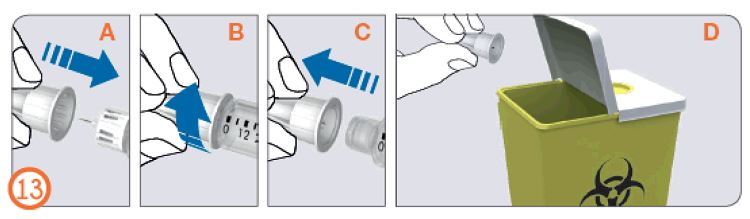
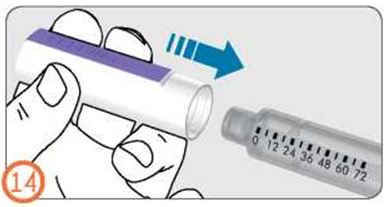
Сақтандыру: Әр пайдаланғаннан кейін қаламға қалпақшаны кигізіңіз.
5.4. Рековелль препараты бар алдын ала толтырылған шприц-қаламын сақтау.
Сақтандыру: Ешқашан шприц-қаламды жалғанған инесімен бірге сақтамаңыз.
Қалпақшасын кигізер алдында Рековелль препараты бар алдын ала толтырылған шприц-қаламынан инесін үнемі шешіп қойыңыз.
Сіз әр инъекциямен енгізетін препараттың мөлшерін мкг-мен жазып қою үшін дозалау күнделігін пайдалануға болады. Күн сайынғы инъекциялар жазылатын осындай күнделікті пайдалану Сізге препараттың толық дозасы енгізілгенін күн сайын бақылап отыруға мүмкіндік береді.
ҚОСЫМША
1-қосымша
Рековелль препараты бар алдын ала толтырылған шприц-қаламын пайдаланып дозаны жинау үлгісі
|
Тағайындалған доза |
Қаламға алынған доза |
Дозаны бақылау терезесінің көрінісі |
|
0,33 |
0 және 1 сызық (0 плюс 1 сытыр жинау) |
 |
|
0,66 (шаятын доза) |
0 және 2 сызық (0 плюс 2 сытыр жинау) |
 |
|
2,33 |
2 және 1 сызық (2 плюс 1 сытыр жинау) |
 |
|
11,00 |
11 (11 жинау) |
 |
|
12,33 |
12 және 1 сызық (12 плюс 1 сытыр жинау) |
 |
|
18,66 |
18 және 2 сызық (18 плюс 2 сытыр жинау) |
 |
|
20,00 |
20 (20 жинау) |
 |
2-қосымша
Дозалау күнделігі
|
Емделу күні |
Күні |
Уақыт |
Қаламның дозалануы |
Тағайындалған доза |
Дозаны бақылау терезесі |
||
|
Енгізуге арналған доза |
Инъекциядан кейін көрінетін сан |
||||||
|
|
|
|
12 мкг/0,36 мл |
|
|
Толық инъекция |
Егер толық емес болса, жаңа қалам көмегімен _____ мкг енгізіңіз |
|
|
|
|
12 мкг/0,36 мл |
|
|
Толық инъекция |
Егер толық емес болса, жаңа қалам көмегімен _____ мкг енгізіңіз |
|
|
|
|
12 мкг/0,36 мл |
|
|
Толық инъекция |
Егер толық емес болса, жаңа қалам көмегімен _____ мкг енгізіңіз |
|
|
|
|
12 мкг/0,36 мл |
|
|
Толық инъекция |
Егер толық емес болса, жаңа қалам көмегімен _____ мкг енгізіңіз |
3-қосымша
Бөлек енгізу кезінде дозаны есептеу үлгісі
|
Тағайындал-ған доза |
Қаламда қалған доза (доза терезесіндегі доза индикаторында көрсетілетін доза) |
Жаңа қаламды пайдаланып инъекция жасауға арналған доза (доза терезесіндегі доза индикаторында көрсетілетін доза) |
|
11,33 |
4,00 (4) |
7,33 (7 және 1 сызық (7 плюс 1 сыртыл жинау) |
|
12,66 |
12,33 (12 және 1 сызық (12 плюс 1 сыртыл) |
0,33 (0 және 1 сызық (0 плюс 1 сыртыл жинау) |
|
11,00 |
3,00 (3) |
8,00 (8 (8 жинау) |
|
12,00 |
6,66 (6 және 2 сызық (6 плюс 2 сыртыл) |
5,34-ті 5,33-ке дейін дөңгелектеу (5 және 1 сызық (5 плюс 1 сыртыл жинау) |
|
18,33 |
8,66 (8 және 2 сызық (8 плюс 2 сыртыл) |
9,67-ні 9,66-ға дейін дөңгелектеу (9 және 2 сызық (9 плюс 2 сыртыл жинау) |
ХОРАПУР (хориондық гонадотропин)
Қазақстан Республикасы
Денсаулық сақтау министрлігі
Фармация комитеті Төрағасының
2018 жылғы “17” 05
№ N015073, N015074 бұйрығымен
БЕКІТІЛГЕН
Дәрілік затты медициналық қолдану жөніндегі нұсқаулық
Хорапур
Саудалық атауы
Хорапур
Халықаралық патенттелмеген атауы Хориондық гонадотропин
Дәрілік түрі
Инъекция үшін ерітінді дайындауға арналған лиофлизацияланған ұнтақ, еріткішпен жиынтықта
Құрамы:
Бір құтының ішінде
белсенді зат – жоғары тазартылған хориондық гонадотропин
1 500 ХБ немесе 5 000 ХБ,
қосымша заттар: лактоза моногидраты, натрий гидроксидінің 1М ерітіндісі.
Бір ампуланың ішінде
Еріткіш: натрий хлориді, хлорсутек қышқылы 10%, инъекцияға арналған су.
Сипаттамасы
Ақ түсті түйіршік түріндегі лиофилизацияланған масса.
Еріткіш - мөлдір, түссіз ерітінді.
Фармакотерапиялық тобы
Жыныстық гормондар және жыныс жүйесінің модуляторлары. Гонадотропиндер және басқа овуляция стимуляторлары. Гонадотропиндер. Хориондық гонадотропин.
АТХ коды G03GA01
Фармакологиялық қаиеттері
Фармакокинетикасы.
АХГ бұлшықет ішіне енгізіледі. Сарысудағы АХГ ең жоғарғы деңгейіне артынша жартылай шығарылу кезеңінің шамамен 30 сағатқа төмендеуімен шамамен 10 сағат (дозаға тәуелді) өткен соң жетеді. АХГ баяу шығарылуы нәтижесінде бірнеше (мысалы, күнделікті) бұлшықетішілік инъекциядан кейін сарысуда жинақталуы мүмкін. АХГ бүйрекпен шығарылады, ал 10-20% несепте өзгермей қалады, бұл ретте қалдығы бета-ядро фрагменті түрінде шығарылуы ықтимал.
Фармакодинамикасы.
Әсер ету механизмі
Адамның хориондық гонадотропині (АХГ) құрамында лютеиндейтін гормон (ЛГ) мен фолликулостимуляциялайтын гормон (ФСГ) үшін ортақ болып табылатын альфа-суббірлігі және АХГ үшін бірегей болып табылатын бета-суббірлігі бар гликопротеин болып табылады. АХГ жүкті әйелдердің несебінен тазарады және гомогенді болып табылмайды. Тіпті жоғары дәрежеде тазартылған өнімдердің құрамында да сиал қышқылының мөлшерімен және белсенділігімен айрықшаланатын бірнеше фракция бар. АХГ мөлшері биологиялық белсенділіктің бірліктерінде көрсетіледі. Хориондық гонадотропиннің гормондық әсері оның гонадтарда (аналық бездер мен аталық бездер) жыныс стероидтарының биосинтезін көтермелеу қабілетіне негізделген. АХГ әсері ЛГ гипофизарлық гонадотропинінің әсеріне сапалық жағынан баламалы. Алайда АХГ жартылай шығарылу кезеңі едәуір ұзағырақ, осылайша, кумулятивті қолданған жағдайда ЛГ-мен салыстырғанда үлкен әсерге ие.Фармакодинамикалық әсерлер АХГ аналық бездерінде гранулездік, тека-, сондай-ақ прогестерон мен эстрадиол өнуін ұстап тұру үшін стромальдік немесе лютеиндік жасушалар стимуляциялайды. Кіші фолликулдардың гранулездік жасушаларында АХГ жоғарғы дозалары көбінесе эстрадиолдың биосинтезін стимуляциялайды, ал жетілген, доминантты фолликулдардың гранулездік жасушаларында және/немесе лютеиндейтін гранулездік жасушаларында АХГ жоғарғы дозалары прогестерон биосинтезін стимуляциялайды. Одан өзге, АХГ репродукцияны (мысалы, ингибин, релаксин, проренин, плазминоген активаторының тежегіші) реттеу үшін маңызды аналық безде биологиялық тұрғыдан белсенді пептидтер өндірілуін стимуляциялайды. Фолликулдары жетілген әйелдерде 5000 ХБ 10000 ХБ дейін АХГ енгізу (мысалы, гонадотропинмен немесе кломифенмен стимуляциялаудан кейін) бұлшықетішілік инъекциядан кейін шамамен 36 сағат өткен соң овуляцияны индукциялайды. Клиникалық тиімділігі және қауіпсіздігі Лейдиг жасушаларында еркектерде АХГ тестостерон мен 17-ОН прогестерон және эстрадиол сияқты басқа стероидтық гормондардың өндірілуін стимуляциялайды. 5000 ХБ АХГ бір рет енгізу ұлдар мен еркектерде тестостерон өндірілуін екі кезеңге ұлғайтады, осының нәтижесінде плазмадағы бірінші ең жоғарғы концентрациясына 2-4 сағаттан соң және екінші ең жоғарғы концентрациясына 3-4 күннен соң жетеді. Эстрадиолдың сарысудағы ең жоғарғы мөлшеріне АХГ енгізгеннен кейін шамамен 24 сағаттан соң жетеді. Бұл принцип крипторхизмді және анорхизмді дифференциялау үшін, сондай-ақ аталық без функциясын гипогонадотропты гипогонадизммен бағалау үшін крипторхизмді дифференциальді диагностикалау үшін пайдаланылады.
Қолданылуы
1500 ХБ
Андрология
Гипогонадотропты гипогонадизм (сондай-ақ АМГ (адамның менопаузалық гонадотропині) немесе ФСГ (фолликул стимуляциялайтын гормон) біріктіргенде) жағдайында ұрпақ өрбіту функциясын қалпына келтіру.
Педиатрия
Аталық ұрық безінің орнына түспеуін емдеу.
5000 ХБ
Ем
Гинекология
Фолликулдар өсімін стимуляциялаудан кейін овуляцияны қосу және лютеинизациялау үшін овуляциясы жоқ немесе олигоовуляциямен әйелдерде.
Қосалқы репродуктивтік технологиялар (ҚРТ), мысалы, экстракорпоральді ұрықтандыру бағдарламасы шеңберінде: Фолликулдар өсімін стимуляциялаудан кейін овуляция және лютеинизация фолликулдарының түпкілікті жетілуін іске қосу.
Педиатрия
Қатарлас гипогонадотропты гипогонадизмі бар ұлдарда жыныстық жетілудің кідіруі.
Диагностикада қолданылуы
Андрология
Стимуляциялаушы ем алдында аталық без функциясын гипогонадотропты гипогонадизммен бағалау.
Педиатрия
Крипторхизмді және анорхизмді дифференциальді диагностикалау.
Қолдану тәсілі
Қолдану тәсілі
«ХОРАПУР» препараты бұлшықет ішіне енгізуге арналған. Пайдаланудың тура алдында ұнтақты жиынтықтағы еріткішпен сұйылту қажет.
Дозалануы
1500 ХБ
Андрология
«ХОРАПУР» препаратымен емдеуді бедеулікті емдеу тәжірибесі бар дәрігердің қадағалауымен жүргізеді.
Гипогонадотропты гипогонадизм жағдайында бірнеше ай бойы АМГ немесе ФСГ біріктірілімде 1 құты «ХОРАПУР» 1500 ХБ аптасына екі рет (аптасына 3000 ХБ хорионгонадотропинге сай келеді).
Ем кемінде 3 ай созылады, осындан кейін ғана сперматогенезде қандай да бір жақсаруды күтуге болады. Осы ем кезінде тестостеронмен орын басу емін тоқтату қажет, сондай-ақ тестостерон деңгейлерін мезгіл-мезгіл мониторингілеу қажет. Тестостерон деңгейлерін қалпына келтіру үшін АХГ дозасын ұлғайту керек болуы мүмкін. АХМ емдеуге жауап жеткіліксіз болғанда қосымша АМГ немесе ФСГ керек болуы мүмкін. Біріктірілген емнің нәтижесінің жақсаруына қол жеткізгеннен кейін кейбір жағдайларда қалыпты деңгейлерді АХГ монотерапиясымен ұстап тұруға болады.
Педиатрия
Аталық ұрық безінің орнына түспеуін емдеуді өмірге келген алғашқы жылдың соңына қарай аяқталу қажет.
Келесі дозалау өмірге келгеніне алғашқы жарты жыл толған балаларға ұсынылған: 250 ХБ/доза (0,17 мл құты 1500 ХБ) бес апта бойы аптасына екі рет.
5000 ХБ
Гинекология
«ХОРАПУР» препаратымен емдеуді бедеулікті емдеу тәжірибесі бар дәрігердің қадағалауымен жүргізеді.
Овуляциясы жоқ немесе олигоовуляциясымен әйелдерді емдеу: «ХОРАПУР» препаратының бір құтысы (5000 ХБ) немесе екі құтысы (10000 ХБ) фолликулдар өсімінің тиімді стимуляциясына қол жеткеннен кейін 24-48 сағаттан соң енгізіледі. Пациентке жыныстық қатынас «ХОРАПУР» препаратын енгізген күні және енгізгеннен соң келесі күні ұсынылады.
Қосалқы репродуктивтік технологиялар (ҚРТ), мысалы, экстракорпоральді ұрықтандыру бағдарламасы шеңберінде: «ХОРАПУР» препаратының бір құтысы (5000 ХБ) немесе екі құтысы (10000 ХБ) ФСГ немесе АМГ препаратын соңғы енгізуден кейін 24-48 сағаттан соң, яғни фолликулдар өсімінің тиімді стимуляциясына қол жеткеннен кейін енгізіледі.
Андрология
Гипогонадотропты гипогонадизмі бар пациенттерде аталық без функциясын бағалау үшін «ХОРАПУР» препаратының 1 құтысын (5000 ХБ) бір рет.
Педиатрия
Ұлдарда жыныстық жетілудің кідіруін индукциялау үшін 3 ай бойы аптасына «ХОРАПУР» препаратының 1 құтысын (5000 ХБ).
Крипторхизмі және анорхизмі бар ұлдарды дифференциальді диагностикалау үшін «ХОРАПУР» препаратының бір құтысын (5000 ХБ) бір рет.
Ерекше популяциялар
Бүйрек/бауыр жеткіліксіздігі
Пациенттер бүйрек немесе бауыр функциясымен клиникалық зерттеулерге қосылмады.
Жағымсыз әсерлер
Ең жиі байқалатын жағымсыз дәрілік реакциялар аналық без гиперстимуляциясымен, яғни АБГС байланысты. Әдетте, мұндай жағымсыз реакциялар дозаға тәуелді болып табылады және пациенттің емге қатысты жеке жауабына байланысты.
Жағымсыз реакцияларды бағалау жиілігі бойынша келесі жіктеуге негізделген:
Өте жиі (≥ 1/10)
Жиі (≥ 1/100 <1/10 дейін)
Жиі емес(≥ 1/1000 <1/100 дейін)
Сирек (≥ 1/10000 <1/1000 дейін)
Өте сирек (<1/10000 дейін)
Белгісіз (қолда бар деректер негізінде анықтау мүмкін емес)
|
MedDRA жүйелік-ағзалық класы |
Өте жиі (≥ 1/10)
|
Жиі (≥ 1/100 <1/10 дейін)
|
Жиі емес (≥ 1/1000 <1/100 дейін)
|
Белгісіз (қолда бар деректер негізінде анықтау мүмкін емес) |
|
Иммундық жүйе тарапынан болатын бұзылыстар |
|
|
|
Аса жоғары сезімталдық реакциялары d |
|
Эндокриндік жүйе тарапынан болатын бұзылыстар |
Гинекомастия3 |
|
|
|
|
Зат алмасу және тамақтану тарапынан болатын бұзылыстар |
|
|
Электролиттер және сұйықтық кідіруі |
|
|
Психикалық бұзылыстар |
|
|
Депрессия, ашушаңдық, мазасыздық |
|
|
Жүйке жүйесі тарапынан болатын бұзылыстар |
Бас ауыруы |
|
|
|
|
Қантамырлар тарапынан болатын бұзылыстар |
|
Қан кернеуb |
|
Тромбоэмболияс |
|
Асқазан-ішек жолы тарапынан болатын бұзылыстар |
|
Жүрек айнуы, іш аумағының ауыруы, құсу |
Диарея |
|
|
Тері және тері асты тіндері тарапынан болатын бұзылыстар |
|
Экзантема, кәдімгі акне |
|
Rash, erythema, pruritus |
|
Жыныс мүшелері және сүт безі тарапынан болатын бұзылыстар |
|
Жеңіл – орташа дәрежедегі АБГСc, сүт бездерінің ісуі, аталық бездің ауыруы |
Ауыр АБГСc |
Сүт бездерінің сезімталдығы және ауыруы |
|
Жалпы сипаттағы асқынулар және енгізген жердегі реакциялар |
Енгізген жердегі реакция |
|
|
Пирексия, қажу, астения |
a Ересек еркектерге қатысты хабарланған әдебиеттік деректер.
b Қан кернеу туралы тек еркектерде хабарланды.
с Жеңіл және орташа дәрежедегі АБГС клиникалық белгілері мен симптомдарына асқазан-ішек жолы тарапынан болатын бұзылыстар (іш аумағының жайсыздығы, іш аумағының ауыруы, іш кебуі, жүрек айнуы, құсу және/немесе іш өту), аналық бездердің жеңіл және орташа ұлғаюы, дене салмағының өсуі, аналық без кистозы кіреді. Ауыр жағдайларда сирек асқынулар ретінде асцит, жамбас сұйықтығы, плевралық экссудат, диспноэ, олигурия, тробоэмболиялық құбылыстар (артериялық және веналық) және аналық бездердің бұралып қалуы туралы хабарланды.
d Жергілікті немесе жайылған аллергиялық реакциялардың жекелеген жағдайлары туралы, оның ішінде анафилаксиялық шок, сондай-ақ тиісті симптомдар туралы хабарланды.
Простатадағы индукция және/немесе пролиферативті өзгерістер нәтижесінде тестостерон өндіру аясында жыныс мүшесінің және эрекцияның ұлғаюы байқалуы мүмкін.
Педиатрия
Ұлдарда ем аяқталғаннан кейін жоғалатын, жыныстық жетілудің басында байқалатынға ұқсас аздаған эмоциялық өзгерістер мезгіл-мезгіл байқалуы мүмкін.
Қолдануға болмайтын жағдайлар
Жалпы
Белсенді затқа немесе қосымша заттардың қандай да біріне аса жоғары сезімталдық.
Гинекология
- Гипофиз немесе гипоталамус ісіктері
- Аналық без кистасы немесе аналық без поликистозынан ерекше себептер бойынша аналық бездің ұлғаюы.
- Этиологиясы белгісіз гинекологиялық қан кетулер
- Аналық без, жатыр немесе емшек карциномасы
- Соңғы 3 айдағы жатырдан тыс жүктілік
- Белсенді фазадағы тромбоэмболиялық бұзылыстар
- Аналық без гиперстимуляциясы синдромы (АБГС)
Келесі жағдайларда, емнің соңы оң болатыны неғайбыл, демек, «ХОРАПУР» препараты мына кездерде тағайындалмайды:
- Овуляцияның бастапқы бұзылуында
- Жүктілікпен үйлеспейтін жыныс мүшелерінің патологиясы
- Жүктілікпен үйлеспейтін жатыр миомасы
- Постменопаузадағы әйелдерде
Педиатрия және андрология
«ХОРАПУР» препаратын жыныс мүшелеріне байланысты ісіктер жағдайында тағайындамаған жөн.
«ХОРАПУР» препаратын шығу тегі белгілі органикалық (шат жарығы, шат аумағындағы операция, эктопиялық аталық без) аталық ұрық безінің орнына түспеуін емдеу үшін тағайындамаған жөн.
Дәрілермен өзара әрекеттесуі
Адамдарда өзара әрекеттесуіне зерттеулер жүргізілмеді.
Айрықша нұсқаулар
Жалпы
АХГ- емді андроген өндірілуінің ұлғаюына және сұйықтық кідіруіне әкеледі. Күдікті жүрек немесе бүйрек ауруы, жоғары қан қысымы, эпилепсиясы немесе бас сақинасы (сондай-ақ анамнезінде) бар пациенттер «ХОРАПУР» препаратын қолдану нәтижесінде өршу немесе қайталану ықтималдығына байланысты мұқият қадағалауды керек етеді (4.8. бөл.қар.).
Тромбоэмболия
Жеке немесе отбасылық анамнез сияқты тромбоэмболиялық құбылыстар даму қаупінің жалпыға мәлім факторлары, семіздігі (дене салмағының индексі > 30 кг/м2) немесе тромбофилиясы бар пациенттерде гонадотропиндермен емделу кезінде немесе одан кейін веналық немесе артериялық тромбоэмболиялық құбылыстардың даму қаупі жоғарылауы мүмкін. Аталған пациенттер тобында гонадотропиндермен емделудің пайдасын қауіптерді ескере отырып таразылау қажет. Дегенмен, жүктіліктің өзінде де тромбоэмболиялық құбылыстардың даму қаупі бар екенін атап айту керек.
Гинекология
Емді бастау алдында, қажет болса белсіздіктің себебін және жүктілік үшін болжамды қарсы көрсетілімдерді бағалау қажет. Атап айтқанда, пациентті гипотиреозға, бүйрекүсті бездері қабығының жеткіліксіздігіне, гиперпролактинемияға, сондай-ақ гипофиздік және гипоталамустық ісіктерге қатысты тексеру және тиісті спецификалық ем жүргізу қажет.
Аналық без гиперстимуляциясы синдромы (АБГС)
Фолликулдар өсімінің стимуляциясынан өткен пациенттерде көптеген фолликулдардың дамуы аясында аналық без гиперстимуляциясы синдромының (АБГС) даму қаупі жоғарылауы мүмкін.
АБГС – бұл аналық бездің асқынбаған ұлғаюынан ерекшеленетін медициналық құбылыс. АБГС – бұл ауырлықтың үдемелі дәрежесімен көрініс табуы мүмкін синдром. Гонадотропиндермен емге аналық бездердің шамамдан тыс жауабы, егер тек АХГ овуляцияны іске қосу үшін қолданылмаса, сирек жағдайларда АБГС себеп болып табылады. Сондықтан, аналық без гиперстимуляциясы жағдайларында АХГ атап өткен жөн және пациентке барьерлік контрацепция тәсілін пайдалануды немесе келесі етеккірлік қан кетуге дейін жыныстық қатынастан тежеле тұруды ұсынған жөн.
АБГС жылдам өршуі (24 сағат ішінде) немесе бірнеше күн бойы күрделі медициналық құбылыс көрсетуі мүмкін. Ерте АБГС, әдетте, АХГ аясында ооциттердің түпкілікті жетілуі іске қосылғаннан кейін алғашқы 9 күн ішінде дамиды, ал кеш АБГС жүктілікті диагностикалау кезінде дамуы мүмкін. Әдетте, АБГС етеккірдің басталуымен өздігінен шешіледі. Егер жүктілік басталса АБГС ауырырақ және ұзағырақ болуы мүмкін. Демек, пациенттерде АХГ қолданғаннан кейін кемінде екі апта ішінде қадағалау қажет.
Әдетте өздігінен шешілетін, жеңіл және орташа дәрежедегі АБГС клиникалық белгілері мен симптомдарына асқазан-ішек жолы тарапынан болатын бұзылыстар (іш аумағының жайсыздығы, іш аумағының ауыруы, іш кебуі, жүрек айнуы, құсу және/немесе іш өту), аналық бездердің жеңіл және орташа ұлғаюы, дене салмағының өсуі, аналық без кистозы кіреді. Ауыр жағдайларда, қосымша симптомдарға аналық бездің күрделі ұлғаюы, диспноэ және олигурия кіреді. Клиникалық деректер сарысулық жыныстық стероидтық гормондардың жоғары деңгейін, гиповолемия, қанның қоюлануын, электролиттік теңгерімсіздікті, асциттер, гемоперитонеум, плевралық экссудат, гидроторакс және/немесе жедел өкпе дистресін көрсетуі мүмкін. Өте сирек жағдайларда ауыр АБГС аналық бездің бұралып қалуымен немесе тромбоэмболиялық құбылыспен асқынуы мүмкін.
АБГС қаупін барынша азайту үшін барлық пациенттерге УДЗ пайдалану арқылы, жекелей немесе эстрадиол деңгейлерін талдаумен біріктіріп, стимуляциялаушы емге дейін және сол уақытта аналық бездің жауабын мұқият қадағалау ұсынылады. «ХОРАПУР» препаратының ұсынылған дозасын, емдеу сызбасын орындау және емнің мұқият мониторингілеу АБГС даму жиілігін барынша азайтады. Қосымша репродуктивтік технология бағдарламасының (ҚРТ) шеңберінде овуляцияға дейін барлық фолликулдарды аспирациялау АБГС даму ықтималдығын төмендетуі мүмкін.
Ауыр АБГС дамыған кезде гонадотропинмен емдеуді тоқтату қажет, егер жағдай сақталса пациентті ауруханаға жатқызу және АБГ спецификалық ем тағайындау қажет.
АБГС аналық без поликистозы (АБП) бар пациенттерде жоғары жиілікпен дамиды.
Көп ұрықты жүктілік:
Көп ұрықты жүктілік, әсіресе ана мен бала үшін жағымсыз аяқталудың жоғары қаупін бір саты жоғары төндіреді.
Гонадотропиндермен овуляция индукциясынан өткен пациенттерде көп ұрықты жүктілік ықтималдығы табиғи бала көтеруге қарағанда жоғарылайды. Көп ұрықты жүктіліктің көптеген жағдайында егіздер туады. Көп ұрықты жүктілік қаупін барынша азайту үшін аналық бездің жауабын мұқият мониторингілеу ұсынылады.
ҚРТ үдерісін өтіп жатқан пациенттерде көп ұрықты жүктілік қаупі әдетте орналасқан эмбриондардың мөлшерімен, олардың сапасымен және пациенттің жасымен байланысты.
Пациент көп ұрықты жүктіліктің потенциалды қаупі туралы ем басталғанға дейін хабардар болуы тиіс.
Шарананың құрақ ішінде өлуі:
Шетінеу немесе аборт нәтижесінде шарананың құрсақішілік жүктілік жиілігі әдеттегі популяциялық топқа қарағанда ҚРТ бағдарламасы шеңберінде фолликулдар өсімінің стимуляциясын өтіп жатқан пациенттерде жоғары.
Эктопиялық жүктілік
Жатыр түтігі аурулары бар әйелдерде жүктілік табиғи жолмен бола ма немесе бедеулікті емдеуден кейін бола ма қарамастан, эктопиялық жүктілік қаупі жоғары. ЭКО кейін эктопиялық жүктіліктің хабарланған жиілігі пациенттердің әдеттегі тобындағы 1-1,5% салыстырғанда 2-5% құрайды.
Репродуктивтік жүйенің неоплазмалары:
Бедеулікке қарсы емнің көптеген тәсілдерін қабылдап жүрген әйелдерде аналық бездер мен репродуктивтік жүйенің басқа да ағзаларының, қатерсіз және қатерлі неоплазмалары туралы хабарланды. Гонадотропиндермен ем бедеу әйелдерде осындай ісіктердің бастапқы даму қаупін ұлғайта ма, әлі де анықталмаған.
Туа біткен даму ақаулары:
ҚРТ кейін туа біткен даму ақауларының жиілігі өздігінен бала көтеруден кейінгі жағдайларға қарағанда аздап жоғарылаулы мүмкін. Бұл болжаммен ата-ананың ерекшеліктері (мысалы, анасының жас шамасы, сперманың сипаттары) мен көп ұрықты жүктіліктегі айырмашылықпен негізделген.
Зертханалық тесттермен интерференция
«ХОРАПУР» препаратын қолданғаннан кейін сарысу/несептегі АХГ иммунологиялық талдау нәтижелері 10 күнге дейін бұрмалануы мүмкін, ал жүктілік бойынша тест нәтижелері жалғаноң болып шығуы мүмкін.
«ХОРАПУР» препаратының құрамында натрий бар, бірақ 1 мл еріткішке 1 ммоль (23 мг) натрийден аз.
«ХОРАПУР» препаратын қолдану допинг-бақылау тестінің оң нәтижелерін беруі мүмкін.
«ХОРАПУР» препаратын допинг түрінде қолдану денсаулыққа зиян тигізуі мүмкін.
Педиатрия
Эпифиздің өсу аймағын ерте тұйықталуын немесе мерзімінен бұрын жыныстық жетілуге жол бермеу үшін препубертаттық жастағы ұлдарда АХГ сақтықпен қолдану, сондай-ақ қаңқаның дамуын мұқият қадағалау қажет.
АХГ қолдану қабыну симптомдарымен және бірінші жылдан кейін аталық безді жібермеу себебімен ем алатын ұлдарда жыныс жасушаларының жоғары апоптозымен байланысты болған.
Фертильділігі
«ХОРАПУР» препараты белсіздікті емдеу үшін қолданылады (4.1. тар.қараңыз).
Жүктілік
Қолданылуын ескере отырып, «ХОРАПУР» препаратын жүктілік кезінде қолданбаған жөн.
Овуляцияны индукциялау үшін АХГ алатын тышқандарда дозаға тәуелді жоғары дәрежеде эмбриондық өлім, атап айтқанда, имплантация алды жойылу байқалды (5.3. тар.қараңыз).
Емшек емізу
Қолданылуын ескере отырып, «ХОРАПУР» препаратын емшек емізу кезінде қолданбаған жөн.
Дәрілік препараттың көлікті немесе қауіпті механизмдерді басқару қабілетіне ықпал ету ерекшеліктері
«ХОРАПУР» препаратын көлік құралдарын жүргізу және механизмдерді басқару қабілетіне ешқандай жағымсыз ықпал көрсетпейді.
Артық дозалануы
Артық дозалану әсерлері белгісіз, дегенмен, аналық без гиперстимуляциясын болжамдауға болады.
Шығарылу түрі және қаптамасы
1500 ХБ немесе 5000 ХБ инъекцияға арналған лиофилизацияланған ұнтақтан қалпақшамен тығындалған резеңке қақпақтары бар түссіз шыныдан жасалған құтыларға салынады.
1 мл еріткіштен сындырудың бақылау нүктесі бар түссіз шыныдан жасалған ампулаларда.
3 құты препараттан және 3 ампула еріткіштен пластик пішінді ұяшықты қаптамаға салынады. 1 пішінді ұяшықты қаптамадан медициналық қолдану жөнінде мемлекеттік және орыс тілдеріндегі нұсқаулықпен бірге картон қорапқа салынған.
Сақтау шарттары
Түпнұсқалық қаптамада, жарықтан қорғалған жерде 25ºС-ден аспайтын температурада сақтау керек.
Мұздатып қатыруға болмайды!
Балалардың қолы жетпейтін жерде сақтау керек.
Сақтау мерзімі
3 жыл
Жарамдылық мерзімі өткеннен кейін қолдануға болмайды.
Дәріханадан босатылу шарттары
Рецепт арқылы
Өндіруші
Ферринг ГмбХ, Германия
Wittland 11 , 24109 Kiel, Germany
Тіркеу куәлігінің ұстаушысы
Ферринг ГмбХ, Германия
Wittland 11 , 24109 Kiel, Germany
Қазақстан Республикасы аумағында тұтынушылардан дәрілік заттың сапасына қатысты шағымдарды (ұсыныстарды) қабылдайтын, дәрілік заттың тіркеуден кейінгі қауіпсіздігін қадағалауға жауапты ұйымның атауы, мекенжайы және байланыс деректері (телефон, факс, электрондық поштасы):
«Ферринг Фармацевтикалс С.А.» Қазақстан Республикасындағы өкілдігі
Қазақстан Республикасы, Алматы қ-сы, 050022, Алмалы ауданы, Наурызбай батыр к-сі, 99/1 үй, 41б кеңсе
Тел.\факс: +7(727) 311-54-47
ЭНДОМЕТРИН (прогестерон)
Қазақстан Республикасы
Денсаулық сақтау министрлігі
Фармация комитеті Төрағасының
2017 жылғы “14” 11
№ N011802 бұйрығымен
БЕКІТІЛГЕН
Дәрілік затты медициналық қолдану жөніндегі нұсқаулық
Эндометрин
Саудалық атауы
Эндометрин
Халықаралық патенттелмеген атауы
Прогестерон
Дәрілік түрі
Қынаптық таблеткалар 100 мг
Құрамы
Бір таблетканың құрамында
белсенді зат – 100 мг микрондалған прогестерон,
қосымша заттар: лактоза моногидраты, желатинделген крахмал, адипин қышқылы, натрий гидрокарбонаты, повидон, магний стеараты, натрий лаурилсульфаты, коллоидты кремнийдің қостотығы,
Сипаттамасы
Эллипс пішінді, сәл тегістелген, иіссіз, ақ түсті таблеткалар
Фармакотерапиялық тобы
Жыныстық гормондар және жыныс жүйесінің модуляторлары. Прогестагендер. Прегнен туындылары. Прогестерон
АТХ коды G03DA04
Фармакологиялық қасиеттері
Фармакокинетикасы
Эстрогенделмеген әйелге 100 мг препаратты қолданғанда қан плазмасында прогестеронның Cmax 6 сағат ішінде жетеді, ал жартылай шығару уақыты 13 сағатты құрайды. 2 рет қолданғанда прогестеронның Cmax 31,61±12,62 нмоль/л құрайды. Плазмада прогестеронның тұрақты концентрациясы препаратты екі дүркін ұзақ қолданғанда байқалады.
Прогестерон сарысу ақуыздарымен, негізінен альбумин және глобулинмен 96-99% байланысады. Прогестерон, негізінен прегнандиолдарға және прегнанолондарға бауырда бастапқы метаболизденеді. Прегнанодиолдар мен прегнанолондар глюкуронид және сульфат метаболиттерімен бауырда конъюгацияланады. Өтке бөлінетін прогестерон метаболиттері деконъюгацияланып, әріқарай ішекте метаболизденуі мүмкін. Прогестерон бүйрек пен бауыр арқылы бөлініп шығады.
Фармакодинамикасы
Эндометрин – прогестерон, аналық бездермен, плацентамен және бүйрекүсті бездерімен сөл бөлетін табиғи стероид. Эстроген мөлшері қалыпты болғанда, прогестерон пролиферацияланатын эндометрийді сөліністенетін түріне өзгертеді. Прогестерон эндометрийдің эмбрион имплантациясына сезімталдығын арттыру үшін қажет. Эмбрион имплантациясынан кейін прогестерон жүктілік ағымын демейді.
Қолданылуы
- бедеулікті емдеу және лютеиндік сатыны демеу кезінде гормон алмастырушы ем
- қосалқы ұрпақ өрбіту технологияларын қолданған кезде
- прогестин жеткіліксіздігі туындатқан патологиялық жағдайды емдеуде
Қолдану тәсілі және дозалары
Эндометрин қоса берілетін аппликатор көмегімен тікелей қынапқа енгізу үшін арналған.
Емдеу ұзақтығы аурудың сипаты және ерекшеліктерімен анықталады. Көптеген жағдайларда прогестерон жеткіліксіздігі кезінде 2-3 қабылдауға Эндометриннің тәуліктік дозасы 200-300 мг құрайды.
Бедеулікті емдеу және лютеиндік сатыны демеуде, қосалқы ұрпақ өрбіту технологияларын қолданған кезде
Овуляция сәтінен бастап 10 – 12 апта гестация бойы (плацентамен прогестеронның тұрақты секрециясы орныққан сәтке дейін) 100 мг Эндометринді күніне 2 рет қабылдау қынаптық қабылдау ұсынылады.
Эндометринді енгізу ережесі
Жағымсыз әсерлері
Жиі ( >l/100 және <l/10)
- бас ауыруы
- жүрек айнуы, құсу, іштің кебуі, іштің ауыруы
Жиі емес (>l/1000 және <l/100)
- ұйқысыздық, бас айналуы
- әлсіздік
- іштің қатуы, диарея
- сүт бездерінің жоғары сезімталдығы, ауыруы, домбығуы
- құрғау, ашыту, генитальді қышыну, қынаптық бөліністер, қан кетулер, айқындығы орташа вагинит, қынаптық микоз сияқты сыртқы жыныс мүшелерінің тарапынан болатын бұзылулар
- шеткері ісінулер, көз астының ісінуі
- көру және сөйлеудің бұзылуы
- синкопальді жай-күй
- терінің және ақ қабықтың сарғаюы
- балтыр бұлшықетінің ауыруы, жансыздану сезімі
- дене салмағының өзгеруі
- пароксизмальді ентігу, кеуденің ауыруы, қан бөлінетін жөтел
Қолдануға болмайтын жағдайлар
- прогестеронға немесе препараттың басқа компоненттеріне аса жоғары сезімталдық
- диагностикаланбаған қынаптық қан кету
- сүт безінде және ұрпақ өрбіту ағзаларындағы қатерлі ісіктердің болуы немесе оның болуынан күдіктену;
- бауыр аурулары және бауыр жеткіліксіздігі
- тромбоздарға бейімділік, тромбофлебит немесе тромбоэмболияның жедел түрлері
- жатырдан тыс жүктілік немесе толық жасалмаған түсік
- лактация кезеңі
- порфирия
Сақтықпен
- жүрек-қантамыр жүйесі аурулары
- артериялық гипертензия
- созылмалы бүйрек жеткіліксіздігі
- қант диабеті
- бронх демікпесі
- эпилепсия
- бас сақинасы
- депрессия
- гиперлипопротеинемия
Дәрілермен өзара әрекеттесуі
Эндометрин басқа қынаптық препараттармен қолдануға ұсынылмайды, өйткені бұл прогестеронның қынаптық таблеткалардан босап шығуына және оның сіңуіне әсер етуі мүмкін. Мұндай үйлесім қажет болған жағдайда препараттарды енгізу арасында алты сағат аралық болуы керек. Р450-3А4 цитохромы жүйесін белсенділендіру әсері белгілі препараттар (рифампицин, карбамазепин сияқты) прогестеронның шығарылуын күшейтуі мүмкін. Кетоконазол (Р450-3А4 цитохромының тежегіші) прогестерон биожетімділігін арттыруы ықтимал. Қынаптық қолдануға арналған қатарлас препараттардың прогестеронның әсер ету ұзақтығына ықпалы бағаланбаған.
Айрықша нұсқаулар
Кіші жамбас мүшелері мен сүт бездеріне ерекше көңіл аудара отырып, пациентті мұқият тексеру керек. Прогестерон біршама дәрежеде сұйықтықтың іркілуіне ықпал етеді, осы фактор түрткі болатын жай-күйді (мысалы, эпилепсия, бас сақинасы, демікпе, жүрек немесе бүйрек жеткіліксіздігі) жүйелі бақылап отыруды талап етеді. Анамнезінде депрессия болған пациенттер мұқият қадағалауды қажет етеді, симптомдары күшейген кезде препаратты тоқтату мүмкіндігін қарастырған жөн.
Миокард инфарктісінің, цереброваскулярлық бұзылулардың, артериялық және веналық тромбоэмболиялардың, торқабық тамырларының тромбофлебиті мен тромбозының ерте нышандарының білінуінен күдіктенгенде эндометринді қолдану тоқтатылуы тиіс.
Ауыр бауыр жеткіліксіздігінде сақтықпен қолдану керек.
Кейбір әдебиет дереккөздері біріктірілген эстроген-гестагендік препараттарын қолданғанда глюкозаға төзімділіктің төмендейтінін сипаттайды. Мұндай әсердің механизмі белгісіз. Осы деректі ескере отырып, анамнезде қант диабеті бар пациенттер де ем жүргізген кезеңде бақылауға мұқтаж болады. Күн сәулесінің әсер етуімен байланысты теріде дақтар пайда болғанда препаратты сақтақпен қолданған жөн.
Жүктілік немесе емшек емізу кезеңінде қолдану
Эндометринді сары дене эндогенді прогестеронды жеткіліксіз өндірген кезде жүктіліктің бірінші триместрінде қолданады. Екі жыныстың балаларында да жыныстық аномалияларды қоса, жүкті кездегі экзогенді прогестеронның әсер етуімен байланысты туа біткен аномалиялар қатері анықталмаған.
Бауыр функциясының бұзылу қаупіне байланысты жүктіліктің II және III триместрінде сақтықпен қолданған жөн.
Прогестерон емшек сүтінен табылады. Эндометрин лактация кезеңінде қолданылмайды.
Педиатрия
Балаларда осы препаратты қолдану жөнінде деректер жоқ. Аталған препарат педиатрияда қолдануға арналмаған.
Дәрілік заттың көлік құралдарын немесе қауіптілігі зор механизмдерді басқару қабілетіне әсер ету ерекшеліктері
Препарат ұйқышылдық пен бас айналуын туғызуы мүмкін. Сондықтан емделу кезінде сақ болу немесе көлік құралын немесе қауіптілігі зор механизмдерді басқаруды қоя тұру керек.
Артық дозалануы
Симптомдары: «Жағымсыз әсерлері» бөлімінде тізбеленген жағымсыз әсерлердің күшеюі.
Емі: тиісті симптоматикалық және демеуші емнің тағайындалуымен дозаны азайту немесе препаратты қолдануды тоқтату.
Шығарылу түрі және қаптамасы
30 таблеткадан пластик контейнерге салынады.
1 контейнерден қынаптық аппликаторы бар медициналық қолдану жөніндегі мемлекеттік және орыс тіліндегі нұсқаулықпен бірге картон қорапқа салынады.
Сақтау шарттары
25 °С-ден аспайтын температурада, түпнұсқалық қаптамасында сақтау керек.
Балалардың қолы жетпейтін жерде сақтау керек!
Сақтау мерзімі
5 жыл
Қаптамасында көрсетілген жарамдылық мерзімі өткеннен кейін қолдануға болмайды.
Дәріханалардан босатылу шарттары
Рецепт арқылы
Өндіруші
Ben Shimon Floris Ltd., Израиль,
Ind.Park, Misgav, 2017400, Израиль
Тіркеу куәлігі иесінің атауы мен елі
Ferring Pharmaceuticals Ltd., Израиль
Қазақстан Республикасы аумағында тұтынушылардан өнім (тауар) сапасына қатысты шағымдарды қабылдайтын ұйымның мекенжайы
«Ферринг Фармацевтикалс С.А.» Қазақстан Республикасындағы өкілдігі
Қазақстан Республикасы
Алматы қ., 050022
Наурызбай батыр к-сі
99/1 үй, 41Б кеңсе
Тел. /факс: +7(727)311 54 47
Дәрілік заттың тіркеуден кейінгі қауіпсіздігін қадағалауға жауапты ұйымның мекенжайы
Қазақстан Республикасы
Алматы қ., 050022
Наурызбай батыр к-сі
99/1 үй, 41Б кеңсе
Тел. /факс: +7(727)311 54 47






