BPT
-
ДЕКАПЕПТИЛ
ДЕКАПЕПТИЛ
(трипторелин)
(трипторелин)
ВРТ -
МЕНОГОН
МЕНОГОН
(менотропин)
(менотропин)
ВРТ -
МЕНОПУР 75
МЕНОПУР 75
(менотропин)
(менотропин)
ВРТ -
МЕНОПУР 600-1200
МЕНОПУР 600-1200
(менотропин)
(менотропин)
ВРТ -
РЕКОВЕЛЛЬ
РЕКОВЕЛЛЬ
(фоллитропин дельта)
(фоллитропин дельта)
ВРТ - Подготовительный этап
- Вымойте руки с мылом.
- Проверьте шприц-ручку на отсутствие повреждений. В случае обнаружения повреждений (например, в случае удара о твердую поверхность или падения), не рекомендуется использовать данную шприц-ручку.
- Проверьте прозрачность содержимого картриджа и наличие взвешенных частиц. Если раствор непрозрачный или в нем имеются взвешенные примеси, не следует применять данный препарат.
- Убедитесь, что используется препарат нужной дозировки.
- Проверьте срок годности на этикетке шприц-ручки.
- На чистой ровной поверхности расположите все предметы, которые могут потребоваться:
- Подготовка предварительно заполненной шприц-ручки с препаратом Рековелль к инъекции
- Возьмите новую иглу (используйте только одноразовые иглы, которые находятся в упаковке с предварительно заполненной шприц-ручкой с препаратом Рековелль).
- Проверьте, что этикетка контроля первого вскрытия внешнего колпачка иглы присутствует и не повреждена. Если этикетка контроля первого вскрытия колпачка иглы повреждена или отсутствует, не используйте эту иглу, выбросьте ее и возьмите другую. Неиспользованные иглы следует утилизировать, не снимая с них внешний колпачок.
- Снимите этикетку контроля первого вскрытия иглы.
- Присоедините внешний колпачок к шприц-ручке и надавите до щелчка.
- Снимите внешний колпачок, слегка потянув за него.
- Держа шприц-ручку иглой вверх, осторожно снимите и выбросьте внутренний колпачок иглы.
- Если Вы видите крохотные капельки жидкости, обратитесь к разделу 3: Установка дозы, назначенной врачом.
- Осторожно поворачивайте ручку дозатора по часовой стрелке, пока в окошке дозы не появится символ в виде капли на линии с индикатором дозы. Если Вы пропустили нужную отметку, ручку дозатора можно повернуть назад.
- Держа ручку иглой вверх, слегка постучите по контейнеру с препаратом.
- Нажмите на кнопку дозатора до упора. На кончике иглы появится крохотная капелька жидкости. Проверьте, что в окошке контроля дозы указ «0».
- Если капелька жидкости не появилась, повторите действия. Если после 5 попыток капелька не появилась, замените иглу и повторите действия по заполнению.
- Установка дозы, назначенной врачом
- Для набора дозы поверните кольцо дозатора от себя (по часовой стрелке).
- Для корректировки дозы поверните ручку дозатора к себе (против часовой стрелки).
- Введение дозы
- Держите шприц-ручку так, чтобы видеть окошко контроля дозы в процессе инъекции.
- Зажмите кожу и медленно введите иглу полностью в кожу.
- Нажмите на кнопку дозатора до упора и удерживайте ее в таком состоянии до завершения инъекции.
- Удерживайте кнопку дозатора в нажатом состоянии до того, как увидите «0» в окошке контроля дозы, затем подождите еще 5 секунд (медленно считая до 5), чтобы гарантировать введение полной дозы.
- Число, отображаемое в окошке контроля дозы, вернется назад к 0.
- Выдержав не менее 5 секунд, вытащите иглу из кожи, отпустив кнопку дозатора в нажатом состоянии.
- При необходимости прижмите к месту инъекции салфетку из марли или ватный тампон.
- Всегда используйте новую иглу для введения каждой инъекции.
- После введения инъекции
- В окошке контроля дозы будет показана недостающая доза препарата, которую нужно ввести с помощью новой шприц-ручки.
- Повторите действия, описанные в разделах 1 («Подготовительный этап») и 2 («Подготовка предварительно заполненной шприц-ручки с препаратом Рековелль к инъекции»), используя новую шприц-ручку.
- Установите дозу, соответствующую недостающей дозе препарата, которую Вы записали в дневнике («доза для новой шприц-ручки» = «назначенная доза» - «доза, оставшаяся в старой шприц-ручке»), или число, которое показано в окошке предыдущей ручки, и введите инъекцию.
- Поместите внешний колпачок иглы на ровную поверхность.
- Крепко держа предварительно заполненную шприц-ручку с препаратом Рековелль в одной руке, вставьте иглу во внешний колпачок иглы.
- Продолжайте натягивать колпачок до щелчка, опираясь о твердую поверхность.
- Держа за внешний колпачок иглы открутите иглу, вращая колпачок против часовой стрелки. Осторожно утилизируйте иглу (поместите в контейнер для острых предметов).
- Никогда не используйте иглы повторно. Никогда не передавайте иглы другим пациентам.
- Наденьте колпачок на ручку.
- При необходимости наружную поверхность шприц-ручки можно очистить влажной тканью. Не помещать в воду или другие жидкости.
- Хранить шприц-ручку в оригинальной упаковке в безопасном месте.
- Когда в шприц-ручке закончится раствор, выбросьте ее.
- Ведение дневника дозирования
- Записывайте день лечения, дату и время каждой инъекции.
- Свою назначенную дозу запишите в разделе «Назначенная доза».
- Перед проведением инъекции проверяйте, что Вы вводите правильную дозу.
- После инъекции записывайте дозу, которую Вы ввели: подтвердите, что Вы ввели правильную дозу или запишите число, указанное в окошке контроля дозы, если оно отличается от «0».
- При необходимости проведите повторную инъекцию с помощью новой ручки, набрав недостающую дозу, указанную в разделе «Число, отображающееся после инъекции».
- Запишите эту недостающую дозу в разделе «Доза для введения» в следующей колонке.
-
ХОРАПУР
ХОРАПУР
(гонадотропин хорионический)
(гонадотропин хорионический)
-
ЭНДОМЕТРИН
ЭНДОМЕТРИН
(прогестерон)
(прогестерон)
ВРТ - Распечатайте аппликатор.
- Закрепите таблетку в специальном месте на конце аппликатора, таблетка не должна выпадать.
- Аппликатор с таблеткой введите глубоко во влагалище, в положении стоя, сидя или лежа на спине с согнутыми коленями.
- Нажмите на поршень аппликатора, чтобы высвободить таблетку. Удалите аппликатор из влагалища и тщательно промойте его в теплой проточной воде, высушите насухо мягкой тканью и отложите для последующего использования.
ДЕКАПЕПТИЛ (трипторелин)
УТВЕРЖДЕНА
Приказом председателя
Комитета Фармации
Министерства здравоохранения
Республики Казахстан
от «07» 08 2018 года
№ N016363
Инструкция по медицинскому применению лекарственного средства
ДЕКАПЕПТИЛ
Торговое название
Декапептил
Международное непатентованное название
Трипторелин
Лекарственная форма
Раствор для инъекций 0,1 мг/мл
Состав
1 мл препарата содержит
активное вещество – трипторелина свободного основания 0.0956 мг
вспомогательные вещества: натрия хлорид, кислота уксусная ледяная, вода для инъекций.
Описание
Прозрачный бесцветный раствор.
Фармакотерапевтическая группа
Антинеопластические и иммуномодулирующие препараты. Эндокринная терапия. Гормоны и их производные. Гонадотропин-рилизинг гормона аналоги. Трипторелин.
Код АТХ L02AE04
Фармакологические свойства
Фармакокинетика
После подкожного введения Декапептила системная биодоступность трипторелина составляет около 100 %. Период полувыведения трипторелина составляет примерно 3-5 ч, что свидетельствует о том, что трипторелин будет выведен из организма в течение 24 ч, и, соответственно, он будет отсутствовать в кровообращении на момент переноса эмбрионов. Метаболизм с образованием более простых пептидов и аминокислот в основном происходит в печени и почках. Трипторелин главным образом выводится с мочой.
Клинические исследования свидетельствуют о том, что риск накопления трипторелина у пациентов с серьезными нарушениями функции печени и почек является незначительным (период полувыведения у таких пациентов составляет приблизительно 8 ч).
Фармакодинамика
Декапептил - трипторелин (Д-Трип-6-гонадорелин) – синтетический декапептидный аналог естественного гонадотропин-рилизинг гормона (ГнРГ). Трипторелин характеризуется большей продолжительностью действия, чем естественный ГнРГ, и имеет двухфазное воздействие на гипофизарном уровне. После начального сильного внезапного повышения концентрации лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) (эффект «вспышки») концентрация ЛГ и ФСГ в крови снижается в связи с десенситизацией гипофизарных рецепторов ГнРГ с последующим значительным снижением функции гонад. Точная продолжительность действия Декапептила не установлена, но угнетение функции гипофиза длится не менее 6 дней после последнего введения препарата. После прекращения введения Декапептила следует ожидать дальнейшего снижения уровней ЛГ в крови, при этом уровни ЛГ возвращаются к исходным значениям примерно через 2 недели.
Угнетение функции гипофиза с помощью Декапептила может предотвратить повышение уровня ЛГ и, таким образом, преждевременную овуляцию и (или) лютеинизацию фолликулов. Лечение с помощью агониста ГнРГ позволяет снизить частоту отмены циклов и повысить частоту наступления беременности в циклах вспомогательных репродуктивных технологий (ВРТ).
Показания к применению
– предупреждение преждевременного повышения уровня лютеинизирующего гормона (ЛГ) у женщин, которым проводят контролируемую гиперстимуляцию яичников в рамках вспомогательных репродуктивных технологий (ВРТ)
Способ применения и дозы
Лечение Декапептилом следует начинать под контролем врача, имеющего опыт в лечении бесплодия у женщин. Декапептил предназначен для подкожного введения один раз в сутки в нижнюю часть брюшной стенки. После первой инъекции рекомендуется наблюдать за пациенткой в течение 30 мин для выявления симптомов возможной аллергической/псевдо-аллергической реакции на инъекцию. При этом необходимо обеспечить наличие надлежащих условий и лекарственных средств для возможного лечения таких реакций. Дальнейшие инъекции пациенты могут проводить самостоятельно при условии получения соответствующих инструкций врача о признаках и симптомах, которые могут свидетельствовать о реакции повышенной чувствительности, о последствиях такой реакции и необходимости немедленного медицинского вмешательства. Для профилактики липодистрофии следует постоянно менять место введения препарата.
Предупреждение преждевременного повышения уровня лютеинизирующего гормона (ЛГ) у женщин, которым проводят контролируемую гиперстимуляцию яичников в рамках вспомогательных репродуктивных технологий (ВРТ)
Лечение можно начинать в начале фолликулярной фазы (2-й или 3-й день менструального цикла) или посередине лютеиновой фазы (21-й - 23-й день менструального цикла или за 5-7 дней до ожидаемого начала менструаций). Контролируемую гиперстимуляцию яичников гонадотропинами следует начинать примерно через 2-4 недели после начала лечения Декапептилом. Необходимо контролировать реакцию яичников методами, которые включают или только УЗИ яичников, или, желательно, УЗИ яичников в сочетании с измерением концентрации эстрадиола, и в случае необходимости корректировать дозу гонадотропинов. После того как соответствующее количество фолликулов достигнет нужного размера, лечение Декапептилом и гонадотропинами прекратить и одноразово ввести инъекцию человеческого хорионического гонадотропина (чХГ) для индукции окончательного созревания фолликулов. Если через 4 недели не будет подтверждена эффективность метода (что определяется либо только подтверждением при УЗИ отслойки эндометрия или, желательно, методом УЗИ в сочетании с определением концентрации эстрадиола), следует рассмотреть вопрос о прекращении лечения Декапептилом. Общая длительность лечения обычно составляет от 4 до 7 недель. При применении Декапептила следует обеспечить поддержку лютеиновой фазы согласно с утвержденными схемами лечения.
Пациентам с нарушениями функции почек или печени не требуется коррекция дозы.
Побочные действия
Очень часто (≥1/10)
- снижение полового влечения, нарушение сна
- головная боль
- приливы
- гипергидроз
- вульвовагинальная сухость, вагинальное кровотечение
Часто (от ≥1/100 до <1/10)
- гиперандрогенизм
- смена настроения, подавленное настроение, чувство тревоги, бессонница, депрессия
- головокружение, утомляемость
- учащенное сердцебиение
- инфекции верхних дыхательных путей, гриппоподобные заболевания
- тошнота, диспепсия, вздутие живота, боль в животе
- облысение
- боль в суставах
- астения, усталость, раздражительность
- увеличение массы тела
- диспареуния, заболевания молочных желез, кровотечение отмены
Нечасто (от ≥1/1000 до <1/100)
- парестезии
- вестибулярное головокружение
- боль в спине, костная боль, мышечные спазмы
- отек, боль покраснение в месте инъекции
- повышение артериального давления
- синдром гиперстимуляции яичников, киста яичника
Редко (от ≥1/10000 до <1/1000)
- рвота
- мышечная боль
- тазовая боль, меноррагия
Неизвестно
- гиперчуствительность, анафилактическая реакция
- спутанность сознания
- нарушение зрения, нечеткость зрения
- диспноэ
- абдоминальный дискомфорт, диарея
- ангионевротический отек, зуд, сыпь, крапивница
- мышечная слабость
- дисменорея, метроррагия, боль в молочных железах, аменорея
- повышение температуры тела, недомогание
- воспаление в месте инъекции
Противопоказания
- повышенная чувствительность к трипторелину или другим компонентам
препарата
- повышенная чувствительность к гонадотропин-рилизинг гормону (ГнРГ) или к любому другому аналогу ГнРГ
- беременность и период лактации
- остеопороз
- поликистоз яичников
- детский возраст до 18 лет
Лекарственные взаимодействия
Необходимо очень осторожно применять трипторелин вместе с препаратами, влияющими на гипофизарную секрецию гонадотропных гормонов, при этом рекомендуется контролировать гормональное состояние пациента.
Нельзя исключать вероятность взаимодействий с обычно используемыми лекарственными препаратами, включая препараты, высвобождающие гистамин.
Особые указания
Применение агонистов ГнРГ может вызвать снижение минеральной плотности костей. С особой осторожностью следует применять препарат для лечения пациентов с дополнительными факторами риска развития остеопороза (например, хроническое злоупотребление алкоголем, курение, длительная терапия препаратами, снижающими минеральную плотность костей, такими как, противосудорожные средства или кортикостероиды, остеопороз в семейном анамнезе, нарушения питания, нервная анорексия).
По имеющимся на данный момент данным, у большинства женщин после отмены лечения костная масса восстанавливается.
Поскольку уменьшение минеральной плотности костей у пациентов с дополнительными факторами риска развития остеопороза может быть более опасным, решение о терапии трипторелином следует взвешенно принимать в каждом отдельном случае и терапию следует начинать только тогда, когда по результатам тщательной оценки определено, что польза от лечения преобладает над риском. При этом следует применять дополнительные меры противодействия снижению минеральной плотности костей.
В редких случаях терапия агонистами ГнРГ может выявить наличие ранее не диагностированной гонадотропной аденомы гипофиза. У таких больных может развиваться гипофизарная апоплексия, характеризующаяся внезапной головной болью, рвотой, нарушением зрения и офтальмоплегией.
У пациентов, получающих терапию агонистами ГнРГ, такими как, трипторелин, наблюдается повышенный риск развития депрессивных состояний. Пациентов необходимо проинформировать об этом и назначать необходимое лечение в случае возникновения соответствующих симптомов.
Стимуляцию яичников необходимо осуществлять под тщательным медицинским наблюдением.
У пациентов с нарушением функции почек или печени конечный период полувыведения трипторелина составляет 7-8 ч по сравнению с 3-5 ч у здоровых пациентов. Несмотря на такое более продолжительное действие, ожидается, что трипторелин будет выведен из кровообращения до момента переноса эмбрионов.
С особой осторожностью следует применять препарат для лечения женщин с признаками и симптомами активных аллергических состояний или известной склонностью к аллергическим реакциям в анамнезе. Не рекомендуется применять Декапептил для лечения женщин с тяжелыми аллергическими состояниями в анамнезе. Женщин репродуктивного возраста необходимо тщательно обследовать до начала лечения, чтобы исключить возможность беременности.
Применение ВРТ связано с повышенным риском развития многоплодной беременности, смерти плода в период беременности, внематочной беременности и врожденных пороков развития. Эти риски сохраняются в случае применения Декапептила в качестве вспомогательной терапии при контролируемой гиперстимуляции яичников. Применение Декапептила при контролируемой гиперстимуляции яичников может повысить риск развития синдрома гиперстимуляции яичников (СГЯ) и кист яичников.
Стимуляция фолликулов, вызванная применением аналогов ГнРГ и гонадотропинов, может заметно усиливаться у небольшого числа предрасположенных пациенток, особенно при наличии синдрома поликистозных яичников.
Подобно другим аналогам ГнРГ, сообщалось о случаях развития синдрома гиперстимуляции яичников (СГЯ) в связи с применением трипторелина в сочетании с гонадотропинами.
Синдром гиперстимуляции яичников (СГСЯ)
СГСЯ включает значительное увеличение размера яичников, высокие уровни половых стероидов в сыворотке крови, а также повышение сосудистой проницаемости, что может привести к накоплению жидкости в брюшной, плевральной и, в редких случаях, перикардиальной полостях.
В тяжелых случаях СГСЯ может наблюдаться следующая симптоматика: абдоминальная боль, вздутие живота, значительное увеличение размера яичников, увеличение массы тела, диспноэ, олигурия и желудочно-кишечные проявления, включая тошноту, рвоту и диарею. При клиническом обследовании могут быть обнаружены гиповолемия, сгущение крови, нарушение баланса электролитов, асцит, гемоперитонеум, плевральный выпот, гидроторакс, острый легочный дистресс-синдром и тромбоэмболические явления.
Чрезмерная реакция яичников на лечение гонадотропинами редко вызывает развитие СГСЯ, кроме случаев, когда для стимуляции овуляции применяют человеческий хорионичекий гонадотропин (чХГ). Соответственно, в случаях развития СГСЯ целесообразно отменить введение чХГ и посоветовать пациентке воздержаться от половых контактов или использовать барьерные методы контрацепции в течение не менее 4 дней. СГСЯ может быстро прогрессировать (от 24 ч до нескольких дней) и стать серьезным медицинским осложнением; соответственно, за состоянием пациенток следует наблюдать в течение не менее двух недель после введения чХГ.
СГСЯ может приобретать более тяжелую и более продолжительную форму в случае наступления беременности. Чаще СГСЯ наблюдается после прекращения гормонального лечения и достигает максимальной тяжести примерно через 7-10 дней после лечения. Обычно СГСЯ проходит самостоятельно с наступлением менструации.
Если наблюдается СГСЯ в тяжелой форме, лечение гонадотропинами необходимо прекратить (если оно еще продолжается), пациентку следует госпитализировать и начать специфическую терапию СГСЯ, которая включает покой, внутривенные вливания растворов электролитов или коллоидов и гепарина.
Этот синдром чаще наблюдается у пациенток с синдромом поликистозных яичников. Риск развития СГСЯ может быть выше в случае применения агонистов ГнРГ в сочетании с гонадотропинами по сравнению с применением только гонадотропинов.
Кисты яичников
На начальном этапе лечения агонистами ГнРГ могут образовываться кисты яичников. Обычно они бессимптомные и нефункциональные.
Миома матки и эндометриоз
Дальнейшее маточное кровотечение во время лечения возникать не должно (кроме первого месяца), в противном случае необходимо проверить уровень эстрогена в плазме крови. Если этот уровень ниже 50 пг/мл, следует искать возможные органические поражения. После прекращения лечения функция яичников восстанавливается, менструальные кровотечения возобновляются через 7-12 недель после последней инъекции.
В течение первой недели лечения следует использовать негормональные контрацептивы, поскольку первичная секреция гонадотропинов может стимулировать овуляцию. Также их следует использовать, начиная с 4-ой недели после последней инъекции до восстановления менструации или до назначения нового метода контрацепции.
Во время лечения миомы матки необходимо регулярно определять размер матки и миомы. Непропорционально быстрое уменьшение размера матки по сравнению с сокращением тканей миомы в отдельных случаях приводило к кровотечению и сепсису.
Беременность и период лактации
Перед началом лечения женщины детородного возраста должны пройти тщательное обследование для исключения вероятности беременности.
Имеющиеся ограниченные данные о применении трипторелина во время беременности не свидетельствуют о повышенном риске врожденных пороков развития. Тем не менее, количество длительных проспективных исследований развития слишком ограничено. Данные исследований на животных не указывают на прямое или косвенное вредное воздействие на течение беременности или послеродовое развитие плода, но есть данные о фетотоксичности и задержке родов. Согласно данным о фармакологическом действии, нельзя исключать неблагоприятное влияние на беременность и на плод, поэтому применение Декапептила во время беременности не рекомендуется.
Во время лечения препаратом и до восстановления менструаций женщинам детородного возраста рекомендуется использовать негормональные методы контрацепции.
Неизвестно, выделяется ли трипторелин в грудное молоко. В связи с потенциальными побочными реакциями на трипторелин у грудных детей рекомендуется прекратить грудное вскармливание до начала и во время применения препарата.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Учитывая побочные действия препарата, следует соблюдать осторожность при управлении транспортным средством или потенциально опасными механизмами.
Передозировка
Симптомы передозировки могут быть вызваны длительным применением препарата. О каких-либо побочных эффектах вследствие передозировки не сообщалось.
Лечение: следует временно прекратить лечение Декапептилом.
Форма выпуска и упаковка
По 1 мл препарата помещают в стеклянные шприц-ампулы с иглами, снабженными защитными колпачками.
По 7 шприц-ампул помещают в пластиковую ячейковую упаковку.
По 1 ячейковой упаковке вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную упаковку.
Условия хранения
Хранить в сухом месте при температуре от 2 до 8 °С.
Хранить в местах недоступных для детей!
Срок хранения
3 года
Не применять после истечения срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Ферринг ГмбХ, Германия
Wittland 11, 24109 Kiel,Germany
Держатель регистрационного удостоверения
Ферринг ГмбХ, Германия
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств от потребителей и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства:
Представительство «Ферринг Фармацевтикалс СА» в Республике Казахстан
Республика Казахстан
050022, г. Алматы, ул. Наурызбай батыра, д.99/1, офис 41Б
Тел.\факс: (727) 311-54–47
МЕНОГОН (менотропин)
УТВЕРЖДЕНА
Приказом председателя
Комитета Фармации
Министерства здравоохранения
Республики Казахстан
от «26» 06 2017 года
№ N009053
Инструкция по медицинскому применению лекарственного средства
МЕНОГОН
Торговое название
Меногон
Международное непатентованное название
Нет
Лекарственная форма
Порошок лиофилизированный для приготовления раствора для инъекций
75 МЕ ФСГ и 75 МЕ ЛГ в комплекте с растворителем
Состав
активное вещество - менотропин (75 МЕ фолликулостимулирующего гормона и 75 МЕ лютеинизирующего гормона)
вспомогательные вещества: лактозы моногидрат, натрия гидроксид, вода для инъекций
Растворитель: натрия хлорид, кислота хлороводородная 10%, вода для инъекций.
Описание
Белый лиофилизированный порошок без запаха, в виде коржа. Растворитель - прозрачный бесцветный раствор.
Фармакотерапевтическая группа
Половые гормоны и модуляторы половой системы. Гонадотропины и другие стимуляторы овуляции. Гонадотропин менопаузный.
Код АТХ G03GA02
Фармакологические свойства
Фармакокинетика
Максимальный уровень фолликулостимулирующего гормона (ФСГ) в плазме крови достигается через 6-48 часов после внутримышечного введения препарата и через 6-36 часов после подкожного введения. После этого концентрация ФСГ в крови постепенно снижается. Период полувыведения гонадотропинов составляет 56 часов после внутримышечного введения и 51 час после подкожного введения.
Биодоступность Меногона выше после подкожного введения, чем после внутримышечного введения. После внутримышечного введения полученные значения для ФСГ составляли: AUC0- = 320,1 млЕ/мл х ч, Cmax = 4,15 млЕ/мл, tmax= 18 ч; после подкожного введения - AUC0- = 385,2 млЕ/мл х ч, Cmax = 5,62 млЕ/мл, tmax = 12 ч.
Человеческий менопаузный гонадотропин выводится преимущественно почками.
Фармакодинамика
Меногон является препаратом человеческого менопаузального гонадотропина. Препарат содержит 75 МЕ фолликулостимулирующего (ФСГ) и 75 МЕ лютеинизирующего гормона (ЛГ), которые вырабатываются гипофизом человека. Действующее вещество получают из мочи женщин в менопаузальном периоде.
Меногон у женщин вызывает повышение уровня эстрогенов в крови, рост и вызревание фолликулов яичника.
Меногон у мужчин индуцирует в семенниках трансформацию незрелых клеток Сертоли в зрелые клетки. Преимущественно влияет на созревание семенных каналов и развитие сперматозоидов. Однако, для этого необходимо наличие высоких внутритестикулярных концентраций андрогенов, что требует проведения предварительного лечения с применением человеческого хорионического гонадотропина (ХГЧ).
Показания к применению
Меногон применяется для лечения бесплодия в следующих клинических ситуациях:
У женщин
- ановуляция (в частности в результате овариального поликистоза яичников), у женщин, которые не отвечали на лечение кломифен цитратом.
- контролируемая гиперстимуляция яичников с целью индукции множественного роста фолликулов при проведении вспомогательных репродуктивных технологий (ВРТ) (оплодотворение in vitro/эмбриональный перенос, внутриутробный перенос гаметы (ВПГ) и интраплазматическая инъекция сперматозоидов (ИЦИС)
У мужчин
- недостаточность сперматогенеза, вызванная гипогонадотропным гипогонадизмом
Способ применения и дозы
Лечение препаратом Меногон должно проводиться под наблюдением врача.
Препарат вводят подкожно или внутримышечно после растворения в прилагаемом растворителе. Препарат должен быть использован сразу после разведения. Следует избегать встряхивания. Не следует применять раствор, если он содержит частицы или является непрозрачным. Индивидуальная реакция яичников на экзогенные гонадотропины варьирует в значительной степени, что не позволяет применять стандартизированные схемы дозирования. Несмотря на это, дозы подбирают индивидуально в зависимости от реакции яичников на лечение. Меногон можно применять в виде монотерапии или вводить в сочетании с агонистами или антагонистами гонадотропин-рилизинг-гормона (ГНРГ). Рекомендуемые дозы и длительность лечения зависят от соответствующего протокола лечения.
Длительность лечения в каждом отдельном случае зависит от индивидуальных особенностей пациентки (уровень эстрадиола и данные ультразвукового исследования).
Ановуляция (в частности, в результате овариального поликистоза яичников)
Целью лечения с применением Меногона является получение одного граафова фолликула, из которого высвобождается ооцит после введения хронического гонадотропина человека (ХГЧ).
Применение Меногона следует начинать в течение первых 7 дней менструального цикла. У некоторых пациенток с гипогонадотропным гипогонадизмом отсутствует менструация и наблюдается низкий уровень выработки эндогенного эстрадиола, поэтому лечение можно начинать в любое время. Рекомендуемая начальная доза составляет 75-150 МЕ в день на протяжении 7 дней. Последующее дозирование необходимо индивидуализировать, основываясь на клинических наблюдениях (включая ультразвуковое исследование яичников и\или контроль уровня эстрадиола). Дозу можно регулировать не чаще одного раза в 7 дней. Рекомендованное одноразовое повышение дозы составляет 37,5 МЕ и не должно превышать 75 МЕ. Максимальная суточная доза препарата не должна превышать 225 МЕ. В случае отсутствия результата на протяжении 4 недель курс лечения следует прекратить и начать новый курс с более высокой дозы.
После достижения оптимального результата ввести разовую дозу хорионического гонадотропного гормона (ХГГ) от 5000 до 10000 МЕ на следующий день после последней введенной дозы Меногона. В день введения ХГГ и на следующий день рекомендуется осуществлять половые контакты. Альтернативным способом является проведение искусственного внутриматочного оплодотворения.
Если наблюдается чрезмерная реакция на применение Меногона, курс лечения необходимо прекратить и не вводить ХГЧ. Пациентка должна использовать негормональные методы контрацепции или отказаться от половых контактов до начала следующих менструальних кровотечений.
Контролируемая гиперстимуляция яичников с целью индукции множественного роста фолликулов при проведении вспомогательных репродуктивных технологий, оплодотворения in vitro.
Для пациентов, которые прошли курс лечения агонистами гонадотропин рилизинг-гормона, лечение Меногоном следует начать приблизительно через 2 недели после начала лечения агонистом.
Рекомендованная начальная доза Меногона составляет 150-225 МЕ в день на протяжении, минимум, первых 5 дней лечения. Основываясь на клинических наблюдениях (включая ультразвуковое исследование и\или контроль уровня эстрадиола), последующее дозирование должно быть индивидуальным, но не превышать 150 МЕ, максимальная суточная доза – 450 МЕ. Длительность лечения не должна превышать 20 дней.
В схемах, которые не предусматривают сниженную регуляцию, лечение Меногоном следует начинать на 2-3 день менструального цикла. Рекомендованная доза и режим дозирования такие же, как предложенные для вышеупомянутых протоколов с применением сниженной регуляции агонистами ХГГ.
Когда необходимое количество фолликулов достигло соответствующего размера, пациенткам вводится разовая доза до 10000 МЕ ХГГ для индукции окончательного созревания фолликула и подготовки к выходу ооцита. Пациентки должны находиться под тщательным наблюдением на протяжении 2 недель после введения ХГГ.
Если наблюдается чрезмерная реакция на применение Меногона, курс лечения необходимо прекратить и не вводить ХГГ. Пациентка должна использовать негормональне контрацептивы или отказаться от половых контактов до начала следующих менструальних кровотечений.
Недостаточность сперматогенеза, вызванная гипогонадотропным гипогонадизмом
При нормализации уровня тестостерона после введения соответствующей дозы ХГГ (например, от 1500 до 5000 МЕ - 3 раза в неделю) в течение 4 - 6 месяцев, Меногон следует вводить 3 раза в неделю в дозе от 75 до 150 МЕ в сочетании с введением ХГГ в рекомендованной дозе 1500 МЕ 3 раза в неделю. Комбинированное лечение должно длиться не менее 3-4 месяцев до наступления улучшения сперматогенеза. Если у пациента в течение этого периода не наблюдается реакции на лечение, то необходимо дальнейшее проведение комбинированной терапии до достижения сперматогенеза. Современные клинические данные показывают, что для достижения сперматогенеза необходим 18-месячный курс лечения.
Побочные действия
Женщины
Наиболее частыми побочными реакциями при лечении Меногоном, сообщаемыми из клинических исследований являлись синдром гиперстимуляции яичников (СГЯ) и реакции в месте введения. В таблице ниже представлены основные побочные реакции у пациентов, получавших лечение Меногоном, реакции классифицированы по системно-органным классам (СОК).
|
Системно-органный класс |
Очень часто |
Часто |
Не часто |
Очень |
|
Нарушения со стороны иммунной системы |
|
|
|
Повышенная чувствительность |
|
Нарушения со стороны нервной системы |
|
Головная боль |
|
|
|
Нарушения со стороны желудочно-кишечного тракта |
|
Тошнота, боль в животе, рвота |
|
|
|
Нарушения со стороны кожи и подкожных тканей |
|
Сыпь |
|
|
|
Нарушения со стороны половых органов и молочной железы |
|
Легкий, умеренный и тяжелый СГЯ |
|
|
|
Общие нарушения и реакции в месте инъекции |
* Реакции и боль в месте инъекции |
Гриппоподобные симптомы |
Лихорадка |
|
* Реакции в месте инъекции наблюдались у 55 - 60% пациентов, которые принимали участие в клинических исследованиях местной переносимости. Примерно в 12% случаев реакции оценивались как тяжелые. В большинстве случаев подобные реакции наблюдались после подкожного введения. После внутримышечного введения, реакции в месте инъекции наблюдались у 13% пациентов, которые принимали участие в исследованиях.
Сообщалось о единичных случаях анафилактических реакций.
В случаях СГЯ сообщалось о единичных случаях тромбоэмболических осложнений и перекруте яичников, связанных с введением гонадотропинов.
Мужчины
В связи с лечением с помощью гонадотропинов сообщалось о случаях гинекомастии, акне и увеличении массы тела. У мужчин также возможны реакции в месте введения и повышенная чувствительность.
Противопоказания
- гиперчувствительность к любому из компонентов препарата
- детский и подростковый возраст до 18 лет
У женщин
- опухоль гипофиза или гипоталамуса
- беременность и период лактации
- кисты или увеличение яичников, которые не являются результатом овариального поликистоза
- гинекологические кровотечения неустановленной этиологии
- карцинома яичника, матки или молочных желез
У мужчин
- опухоль гипофиза или гипоталамуса
- карцинома простаты
- опухоли яичек
В нижеописанных случаях лечение Меногоном не принесет желаемых результатов:
- первичная несостоятельность яичников
- аномалии половых органов, несовместимые с беременностью
- фиброзные новообразования матки, несовместимые с беременностью
- первичная недостаточность яичек (у мужчин)
Лекарственные взаимодействия
Не смешивать с другими лекарственными средствами.
Несмотря на отсутствие клинического опыта, предполагается, что одновременное применение Меногона и кломифена цитрата может усиливать реакцию фолликулярного созревания. При совместном применении Меногона с агонистами гонадотропного рилизинг гормона с целью гипофизарной десенсибилизации могут понадобиться более высокие дозы Меногона для достижения желаемой реакции со стороны яичников.
Особые указания
Меногон сильнодействующий гонадотропный препарат, способный вызывать побочные эффекты разной степени тяжести. Поэтому препарат следует применять только под наблюдением врача, хорошо владеющего методами лечения бесплодия. Терапия с помощью гонадотропинов занимает определенное время у врачей и требует тщательного, регулярного контроля реакции яичников на лечение, включающего ультразвуковое исследование, желательно в сочетании с определением уровня эстрадиола в плазме крови. Реакция на введение менотропина у пациентов может быть разной, причем в некоторых из них - очень низкой. Для достижения целей терапии следует применять самую низкую эффективную дозу препарата, которая соответствует цели лечения.
Прежде чем начать лечение, необходимо провести исследование причин бесплодия у обоих партнеров, а также провести медицинское обследование относительно наличия возможных противопоказаний. В частности, пациенток необходимо обследовать на наличие гипотиреоидизма, адренокортикальной недостаточности, гиперпролактинемии, гипофизарной или гипоталамической опухоли, назначить соответствующее лечение, предусмотренное при этих патологических состояниях. Перед началом лечения бесплодия у женщин следует оценить функциональное состояние яичников (ультразвуковая диагностика и уровень эстрадиола в крови). Первая инъекция Меногона должна быть проведена под тщательным контролем врача. У пациенток, которым проводится стимуляция роста фолликулов, может наблюдаться увеличение размера яичников или развиваться синдром гиперстимуляции яичников. Соблюдение рекомендуемого режима дозирования Меногона и тщательный контроль за реакцией яичников помогут минимизировать риск развития этих побочных эффектов. Экспресс-оценка показателей созревания фолликулов требует от врача соответствующего опыта интерпретации таких тестов.
Синдром гиперстимуляции яичников (СГЯ)
СГЯ отличается от неосложненного увеличения яичников. СГЯ является синдромом, тяжесть симптомов которого может увеличиваться. Его признаки включают в себя увеличение яичников, высокие уровни половых гормонов и увеличение проницаемости сосудов, что может приводить к накоплению жидкости в перитонеальной, плевральной и, в отдельных случаях, перикардиальной полостях.
В тяжелых случаях СГЯ могут наблюдаться следующие симптомы: боль
в животе, вздутие живота, чрезмерное увеличение яичников, увеличение массы тела, одышка, олигурия и желудочно-кишечные симптомы, такие как тошнота, рвота и диарея. При клиническом обследовании могут быть выявлены гиповолемия, сгущение крови, нарушение электролитного баланса, асцит, гемоперитонеум, плевральный выпот, гидроторакс, острый легочный дистресс-синдром и тромбоэмболия.
Чрезмерная овариальная реакция на лечение гонадотропинами редко приводит к развитию СГЯ, за исключением случаев, когда для стимуляции овуляции применяется ХГЧ. Поэтому при овариальной гиперстимуляции следует воздерживаться от применения стимуляции с помощью ХГЧ и посоветовать пациентке воздерживаться от половых контактов или использовать барьерные методы контрацепции в течение не менее 4 дней. СГЯ может очень быстро прогрессировать (от 24 часов до нескольких дней) и приобретать серьезную симптоматику. Поэтому, пациентка должна находиться под контролем врача в течение 2 недель после введения ХГЧ.
Минимизировать риск развития гиперстимуляции яичников и многоплодных
беременностей можно, соблюдая рекомендованные дозы и режим введения
препарата, а также контролируя курс лечения. При проведении ВРТ риск развития гиперстимуляции можно снизить путем аспирации всех фолликулов перед овуляцией.
СГЯ может приобрести тяжелые формы и быть более длительным в случае наступления беременности. Чаще всего СГЯ развивается после завершения гормонального лечения и достигает максимальной частоты примерно через 7-10 дней после окончания лечения. Обычно СГЯ самостоятельно проходит при наступлении менструации.
В случае тяжелого СГЯ лечение гонадотропинами следует прекратить (если это не было сделано ранее), пациентку госпитализировать и начать специфическое лечение СГЯ.
СГЯ чаще встречается у женщин с синдромом поликистозных яичников (СПЯ).
Многоплодная беременность
Многоплодные беременности, особенно при большом количестве плодов, повышают риск осложнений для матери и ребенка.
У пациенток, у которых овуляция наступает в результате лечения гонадотропным гормоном, учащаются случаи многоплодия сравнительно с беременностью в результате естественного оплодотворения. Для минимизации риска многоплодия необходимо вести тщательное наблюдение за реакцией яичников пациентки. У пациенток, которым проводятся процедуры ВРТ, риск многоплодной беременности главным образом зависит от количества пересаженных эмбрионов, их качества и возраста пациентки.
До начала лечения пациентку следует проинформировать о потенциальном риске многоплодных беременностей.
Невынашивание
Количество случаев невынашивания беременности выше у женщин, которым проводилась стимуляция созревания фолликулов или при проведении программы вспомогательных репродуктивных технологий, чем в случаях естественного зачатия.
Внематочная беременность
У женщин с заболеваниями маточных труб отмечают высокий риск развития внематочной беременности, чем в случаях естественного зачатия или вследствие лечения бесплодия. Сообщалось, что после проведения вспомогательных репродуктивных технологий (ВРТ) частота случаев внематочной беременности составляла 2-5 % в сравнении с 1-1,5 % случаев естественного зачатия.
Новообразования репродуктивных органов
У женщин, которые неоднократно получали медикаментозное лечение по поводу бесплодия, наблюдалось развитие как доброкачественных, так и злокачественных новообразований яичников и других органов репродуктивной системы, связь между лечением с применением гонадотропина и склонностью к новообразованиям не выяснена.
Врожденные пороки развития
Распространенность врожденных пороков развития плода у женщин после проведения ВРТ может незначительно превышать количество пороков при естественном зачатии, это может быть результатом индивидуальных особенностей родителей (например, возраст матери, характеристики спермы и т.д.) и многоплодная беременность.
Тромбоэмболические нарушения
У женщин с повышенным риском развития тромбоэмболических состояний ввиду наследственной предрасположенности, ожирением (индекс массы тела > 30 кг/м2) или тромбофилией могут развиваться венозные или артериальные тромбоэмболические нарушения как во время, так и после окончания лечения гонадотропином. У таких женщин пользу от применения
гонадотропинов следует сопоставить с возможным риском. Следует отметить, что сама по себе беременность также несет повышенный риск тромбоэмболических осложнений.
Мужчины
Повышенные эндогенные уровни ФСГ свидетельствуют о первичных тестикулярных расстройствах. Такие пациенты не реагируют на лечение с применением Меногона/ХГГ.
Терапевтический эффект оценивают по анализу спермы через 4-6 месяцев после начала лечения.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
Учитывая побочные действия, следует соблюдать осторожность при управлении автотранспортом и потенциально опасными механизмами.
Передозировка
Симптомы: возможно развитие синдрома гиперстимуляции яичников.
Лечение: При легкой степени гиперстимуляции I степени наблюдается незначительное увеличение яичников (размер яичников 5-7 см), чрезмерная секреция стероидных гормонов и абдоминальные боли, при даннй степени специфического лечения не требуется. Пациентка должна находиться под тщательным медицинским контролем. При гиперстимуляции II степени могут наблюдаться кисты яичников (размер яичников 8-10 см), абдоминальные симптомы, тошнота и рвота, при данной степени показан клинический мониторинг и симптоматическое лечение или, при необходимости, внутривенное введение кровозаменителей с высокой гемоконцентрацией. Гиперстимуляция тяжелой степени III степени может сопровождаться большими кистами яичников (размер яичников > 10 см), асцитом, гидротораксом, абдоминальными симптомами, одышкой, задержкою выведения солей, сгущением крови, повышенной вязкостью крови, повышенной агрегацией тромбоцитов с риском развития тромбоэмболии, при данной степени необходима обязательная госпитализация пациентки, поскольку в таких случаях могут развиться состояния, угрожающие жизни, что требуют интенсивного медицинского вмешательства.
Форма выпуска и упаковка
Препарат, содержащий 75 МЕ фолликулостимулирующего гормона и 75 МЕ лютеинизирующего гормона помещают в бесцветные стеклянные ампулы.
По 1 мл растворителя разливают в ампулы бесцветного стекла с контрольной точкой перелома.
По 5 ампул с препаратом и 5 ампул с растворителем помещают в контурную ячейковую упаковку. По 1 или 2 контурных ячейковых упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
Условия хранения
Хранить в оригинальной упаковке, при температуре не выше 25 ºС.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Приготовленный раствор использовать сразу после разведенния.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
Ферринг ГмбХ, Германия
Wittland 11, 24109, Kiel, Germany
Владелец регистрационного удостоверения
Ферринг ГмбХ, Германия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара), ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства)
Представительство «Ферринг Фармацевтикалс С.А.» в Республике Казахстан
Республика Казахстан
г. Алматы, ул. Наурызбай батыра, д.99/1, офис 41Б
Тел./факс: (727) 311-54–47
МЕНОПУР (менотропин)
УТВЕРЖДЕНА
Приказом председателя
Комитета фармации
Министерства здравоохранения
Республики Казахстан
от «02» 02 2018 г.
№ N013379
Инструкция по медицинскому применению лекарственного средства
Менопур
Торговое название
Менопур
Международное непатентованное название
Нет
Лекарственная форма
Порошок лиофилизированный для приготовления раствора для инъекций (75 МЕ ФСГ и 75 МЕ ЛГ) в комплекте с растворителем
Состав
Один флакон содержит
активное вещество - менотропин (человеческий менопаузальный гонадотропин высокоочищенный, чМГ), что соответствует 75 МЕ ФСГ (фолликулостимулирующего гормона) и 75 МЕ ЛГ (лютеинизирующего гормона,
вспомогательные вещества: лактозы моногидрат, полисорбат 20, натрия гидроксид, кислота хлороводородная.
Растворитель: натрия хлорид, кислота хлороводородная 10%, вода для инъекций.
Описание
Лиофилизированная масса в виде комочка белого или почти белого цвета
Фармакотерапевтическая группа
Препараты для лечения заболеваний урогенитальных органов и половые гормоны. Половые гормоны и модуляторы половой системы. Гонадотропины и другие стимуляторы овуляции. Гонадотропины. Гонадотропин менопаузальный.
Код АТХ G03GA02
Фармакологические свойства
Фармакокинетика
Максимальный уровень фолликулостимулирующего гормона (ФСГ) в плазме крови достигается через 6-24 часа после внутримышечного введения препарата. После этого концентрация ФСГ в крови постепенно снижается. Период полувыведения гонадотропинов 4-12 часов.
Фармакодинамика
Менопур является препаратом менопазуального человеческого гонадотропина высокой степени очистки. Препарат содержит фолликулостимулирующий и лютеинизирующий гормоны в соотношении 1:1, по 75 МЕ ФСГ и ЛГ, которые вырабатываются гипофизом человека. Действующее вещество получают из мочи женщин в период постменопаузы. Менопур у женщин вызывает повышение уровня эстрогенов в крови, рост и созревание фолликулов яичника.
Показания к применению
У женщин:
- женское бесплодие, обусловленное ановуляцией (включая синдром поликистозных яичников) у женщин, которые не отвечают на лечение кломифен цитратом
- контролируемая гиперстимуляция яичников с целью индукции множественного роста фолликулов при проведении вспомогательных репродуктивных технологий (ВРТ), например, оплодотворения in vitro, а также интраплазматической инъекции сперматозоидов
У мужчин:
- стимуляция сперматогенеза при азооспермии или олигоастеноспермии, обусловленными первичным или вторичным гипогонадотропным гипогонадизмом (в сочетании с препаратами чХГ).
Способ применения и дозы
Менопур предназначен для подкожного или внутримышечного применения. Порошок растворяют непосредственно перед введением, используя растворитель, который прилагается. В 1 мл растворителя может быть разведено до 3 флаконов порошка Менопур. Следует избегать встряхивания. Раствор не следует применять, если он содержит частицы и не прозрачен. Лечение препаратом Менопур следует проводить только под контролем врача, имеющего соответствующую специализацию и опыт лечения бесплодия.
Доза препарата, описанная ниже, является одинаковой как для п/к, так и для в/м способа введения. Установлено, что яичники неодинаково реагируют на введение гонадотропинов. По этой причине невозможно разработать универсальную схему дозирования. Доза должна подбираться индивидуально в зависимости от реакции яичников. Препарат Менопур применяют в виде монотерапии или в комбинации с агонистами или антагонистами гонадотропин-рилизинг-гормона (ГнРГ). Рекомендуемые дозы и продолжительность терапии зависят от применяемой схемы лечения.
У женщин:
Ановуляция (включая СПКЯ)
Целью лечения препаратом Менопур является развитие одного зрелого фолликула, из которого после введения препаратов хорионического гонадотропина (чХГ) выйдет ооцит.
Лечение обычно начинают в первые 7 дней менструального цикла. Рекомендуемая начальная доза препарата Менопур составляет 75–150 МЕ в сутки в течение не менее 7 дней. Дальнейшую схему лечения подбирают после мониторинга ответа яичников на проводимую терапию на основании результатов ультразвукового исследования (УЗИ) в сочетании с определением концентрации эстрадиола в плазме крови. При отсутствии реакции яичников доза увеличивается на 37,5 МЕ (одно введение) не чаще 1 раза в неделю, каждое последующее повышение не должно превышать 75 МЕ. Максимальная суточная доза не должна превышать 225 МЕ. Если терапевтический ответ не достигнут в течение 4 недель, следует прекратить лечение и начать новый цикл с более высоких начальных доз.
При достижении адекватного ответа яичников на следующий день после последней инъекции препарата Менопур однократно вводят 5000-10000 МЕ чХГ для индукции овуляции. Пациентке рекомендуется иметь половые контакты в день введения чХГ и на следующий день после введения. В качестве альтернативного метода возможно проведение внутриматочной инсеминации. Пациентка должна находиться под постоянным наблюдением в течение не менее 2 недель после введения чХГ. При чрезмерной реакции яичников на введение препарата Менопур курс терапии необходимо прекратить и отказаться от введения чХГ. Пациентке рекомендуется использовать барьерные методы контрацепции или воздержание от половых контактов до наступления менструации.
Контролируемая гиперстимуляция яичников с целью индукции роста множественных фолликулов при проведении ВРТ
Согласно протоколу применения агонистов ГнРГ в соответствии с принципом обратной связи, лечение препаратом Менопур следует назначать примерно через 2 недели после начала лечения агонистами ГнРГ. Если схема лечения не предполагает предварительного применения агонистов ГнРГ, введение препарата Менопур следует начинать на 2 или 3 день менструального цикла совместно с антагонистами ГнРГ. Рекомендуемая начальная суточная доза препарата Менопур составляет 150-225 МЕ в течение не менее 5 первых дней лечения. Дальнейшую схему лечения подбирают после мониторинга ответа яичников на проводимую терапию на основании результатов УЗИ в сочетании с определением концентрации эстрадиола в плазме крови. Рекомендуемая повышающая доза не должна превышать 150 МЕ. Максимальная суточная доза препарата Менопур не должна превышать 450 МЕ. Общая продолжительность терапии не должна превышать 20 дней.
При достижении оптимальной реакции яичников после последней инъекции препарата Менопур назначается одна инъекция чХГ в дозе 10000 МЕ для индукции окончательного созревания фолликулов и индукции выхода ооцита. Пациентка должна находиться под постоянным наблюдением в течение не менее 2 недель после введения чХГ. При чрезмерной реакции яичников на введение препарата Менопур курс терапии необходимо прекратить и отказаться от введения чХГ. Пациентке рекомендуется использовать барьерные методы контрацепции или воздержание от половых контактов до наступления менструации.
У мужчин:
У мужчин для стимуляции сперматогенеза при гипогонадотропном гипогонадизме препарат Менопур рекомендуется применять в дозе от 75 МЕ до 150 МЕ 3 раза в неделю вместе с инъекциями чХГ в дозе 1500 МЕ 3 раза в неделю, если предшествующая терапия препаратами чХГ (введение 1500-5000 МЕ чХГ 3 раза в неделю) на протяжении 4-6 месяцев привела к нормализации концентрации тестостерона в плазме крови. Лечение по этой схеме следует продолжать не менее 4 месяцев до улучшения сперматогенеза. При отсутствии положительного эффекта в течение этого времени комбинированная терапия может быть продолжена до получения положительного результата терапии. Согласно исследованиям, для улучшения сперматогенеза может понадобиться не менее 18 месяцев лечения.
Побочные действия
Частота побочных эффектов: часто (≥ 1/100 до <1/10), нечасто (≥ 1/1000 до <1/100), редко (≥ 1/10000 до <1/1000), частота не установлена (в настоящее время данные о распространенности побочных реакций отсутствуют, зарегистрированы в период пострегистрационного применения препарата).
Наиболее серьезными и частыми побочными реакциями, выявленными при применении препарата Менопур в клинических исследованиях с частотой до 5%, были синдром гиперстимуляции яичников (СГЯ), боль в животе, головная боль, вздутие живота и боль в месте инъекции. Основные побочные реакции, выявленные в клинических исследованиях и в ходе пострегистрационного применения, приведены ниже в таблице.
|
Системно-органный класс |
Часто (≥1/100, <1/10) |
Нечасто (≥1/1000, <1/100) |
Редко (≥1/10000, <1/1000) |
Частота неизвестна |
|
Нарушения со стороны иммунной системы |
|
|
|
Местные или общие аллергические реакции, в т.ч. анафилактические реакции |
|
Нарушения со стороны нервной системы |
Головная боль |
Головокружение |
|
|
|
Нарушения со стороны органа зрения |
|
|
|
Преходящая слепота, диплопия, мидриаз, скотома, фотопсия, преходящее помутнение стекловидного тела, снижение четкости зрения |
|
Нарушения со стороны сосудов |
|
Приливы жара |
|
Тромбоэмболические явления |
|
Нарушения со стороны желудочно-кишечного тракта |
Боль в животе, вздутие живота, тошнота, увеличение живота в объеме |
Рвота, дискомфорт в животе, диарея |
|
|
|
Нарушения со стороны кожи и подкожных тканей |
|
|
Угревая сыпь, кожные высыпания |
Кожный зуд, крапивница |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
|
|
|
Боль в суставах, боль в спине и шее, боль в конечностях |
|
Нарушения со стороны половых органов и молочной железы |
СГЯ*, тазовая боль (боль в области придатков матки); у мужчин - гинекомастия |
Кисты яичников, боль и дискомфорт в молочных железах, нагрубание и отечность молочных желез, боль в сосках |
Скопление жидкости в полости таза |
Перекрут яичника |
|
Общие расстройства и нарушения в месте введения |
Боль в месте инъекции |
Повышенная утомляемость |
|
Гипертермия в месте введения, недомогание |
|
Лабораторные и инструментальные данные |
|
|
|
Увеличение массы тела |
* При применении препарата Менопур в клинических исследованиях отмечались связанные с развитием СГЯ нарушения со стороны желудочно-кишечного тракта, такие как вздутие и дискомфорт в животе, тошнота, рвота и диарея. В случаях тяжелого СГЯ в качестве редких осложнений возможно развитие асцита и скопления жидкости в полости таза, экссудативного плеврита, одышки, олигурии, тромбоэмболических осложнений и перекрута яичника.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Противопоказания
повышенная чувствительность к компонентам препарата и растворителя;
- опухоли гипофиза и гипоталамуса;
- детский возраст до 18 лет;
- нарушение функции печени или почек.
У женщин:
- рак яичников, матки или молочной железы;
- беременность и период грудного вскармливания;
- вагинальное кровотечение неясной этиологии;
- наличие кист или увеличение размера яичников, не связанных с СПКЯ;
- первичная недостаточность функции яичников;
- аномалии развития половых органов, несовместимые с беременностью;
- миома матки, несовместимая с беременностью;
- преждевременная менопауза.
У мужчин:
- рак предстательной железы;
- опухоль яичек;
- первичная недостаточность функции яичек.
Лекарственные взаимодействия
Несмотря на отсутствие клинического опыта, ожидается, что одновременное применение Менопура с кломифеном может усиливать реакцию созревания фолликулов. При совместном применении с агонистами гонадотропин-рилизинг фактора с целью гипофизарной десенсибилизации могут понадобиться высокие дозы Менопура для достижения желаемой реакции со стороны яичников.
Особые указания
Менопур – сильнодействующий гонадотропный препарат, способный вызвать побочные эффекты различной степени тяжести, его следует применять исключительно под наблюдением врача, хорошо владеющего методами лечения бесплодия.
Терапия гонадотропинами требует от врачей определенной затраты времени и требует тщательного и регулярного контроля реакции яичников на лечение, включающее ультразвуковое исследование, желательно в сочетании с определением уровня эстрадиола в плазме крови.
Существуют значимые различия между пациентами при введении менотропина, у некоторых их них возможен очень низкий ответ на лечение. Следует применять минимальную дозу, соответствующую цели лечения.
Первую инъекцию Менопура следует сделать под наблюдением врача.
Прежде чем начать лечение, необходимо провести исследование причин бесплодия у обоих партнеров, а также провести медицинское обследование относительно возможных противопоказаний. В частности, пациенток необходимо обследовать на наличие гипотиреоидизма, адренокортикальной недостаточности, гиперпролактинемии, гипофизарной или гипоталамической опухоли, назначить соответствующее лечение, предусмотренное при таких патологических состояниях.
У пациенток, которым проводится стимуляция роста фолликулов как в рамках лечения бесплодия в результате ановуляции, так и в рамках программы вспомогательных репродуктивных технологий (ВРТ), может наблюдаться увеличение размера яичников или развиваться синдром гиперстимуляции яичников. Соблюдение рекомендованного режима дозирования Менопура и тщательный контроль реакции яичников на лечение помогут минимизировать риск развития этих побочных эффектов. Экспресс-оценка показателей созревания фолликулов требует от врача соответствующего опыта и интерпретации таких тестов.
Синдром гиперстимуляции яичников (СГЯ)
СГЯ – состояние, отличающееся от неосложненного увеличения яичников. СГЯ является синдромом, который появляется сам по себе, а тяжесть симптомов, которого может нарастать.
Синдром проявляется в значительном увеличении размеров яичников, повышении уровня половых стероидных гормонов, а также повышенной проницаемости кровеносных сосудов, что может приводить к скоплению жидкости в брюшной, плевральной и, в исключительных случаях – в перикардиальной полости.
В тяжелых случаях СГЯ могут наблюдаться следующие симптомы: боль в животе, вздутие живота, значительное увеличение яичников, увеличение массы тела, одышка, олигурия и гастроинтестинальные симптомы, такие как тошнота, рвота и диарея. При клиническом обследовании можно обнаружить гиповолемию, электролитный дисбаланс, асцит, гемоперитонеум, плевральный выпот, гидроторакс, острый легочный дистресс-синдром и эпизоды тромбоэмболии.
Повышенная реакция яичников на лечение гонадотропином редко приводит к СГЯ, за исключением случаев, когда для стимуляции овуляции применяют чХГ. Поэтому в случаях возникновения СГЯ следует воздержаться от применения стимуляции с помощью чХГ, а также рекомендовать пациенткам воздерживаться от половых контактов или использовать барьерные методы контрацепции в течение 4 дней минимум. СГЯ может иметь быстрое начало (от суток до нескольких дней) и является серьезным побочным эффектом, поэтому пациенткам следует находиться под наблюдением врача в течение не менее 2 недель после введения ХГГ.
Соблюдение рекомендованного режима дозирования Менопура и тщательный контроль во время лечения позволит минимизировать риск возникновения гиперстимуляции яичников и многоплодной беременности. При проведении программы вспомогательных репродуктивных технологий (ВРТ) аспирация всех фолликулов до наступления овуляции поможет снизить риск возникновения гиперстимуляции.
СГЯ может приобрести тяжелые формы и быть длительным в случае наступления беременности. Обычно СГЯ самостоятельно проходит при наступлении менструации.
В тяжелых случаях СГЯ введение гонадотропина необходимо прекратить, а пациентку следует госпитализировать для проведения специального лечения.
Синдром чаще развивается у пациенток с поликистозом яичников.
Многоплодная беременность
Многоплодная беременность, особенно при большом количестве плодов, несет повышенный риск возникновения осложнений, как для матери, так и для плода в перинатальный период.
У пациенток, у которых овуляция наступает в результате лечения гонадотропным гормоном, учащаются случаи многоплодия по сравнению с беременностью в результате естественного оплодотворения. Для минимизации риска многоплодия необходимо вести тщательное наблюдение за реакцией яичников женщины.
У пациенток после проведения ВРТ риск многоплодной беременности связан, главным образом, с количеством перенесенных эмбрионов, их качеством и возрастом пациентки.
До начала лечения пациенток следует предупредить о возможности возникновения у них многоплодной беременности.
Невынашивание беременности
Количество случаев невыношенных беременностей в результате прерывания беременности или спонтанных абортов выше у женщин, подвергающихся стимуляции созревания фолликулов или проходящих программы вспомогательных репродуктивных технологий (ВРТ), чем в случае естественного зачатия.
Внематочная беременность
Женщины с заболеваниями маточных труб имеют большой риск развития внематочной беременности, чем в случаях здорового зачатия или лечения бесплодия. Частота эктопической беременности после проведения фертилизации in vitro составляет 2-5% по сравнению с 1-1,5 % в популяции.
Новообразования репродуктивных органов
У женщин, которые неоднократно получали медикаментозное лечение по поводу бесплодия, сообщалось о развитии как доброкачественных, так и злокачественных новообразований яичников и других органов репродуктивной системы. На сегодня еще не выяснена связь между лечением с применением гонадотропина и склонностью к новообразованиям у женщин, больных бесплодием.
Врожденные пороки развития
Распространенность врожденных пороков развития у женщин после проведения ВРТ может немного превышать количество пороков при естественном зачатии. Считается, что это может быть результатом индивидуальных особенностей родителей (возраст матери, характеристики спермы и т.д.) и многоплодной беременности.
Тромбоэмболические нарушения
У женщин с повышенным риском развития тромбоэмболических состояний, несмотря на наследственную предрасположенность, существенное ожирение (индекс массы тела > 30 кг/м2 ) или тромбофилии могут развиваться венозные или артериальные тромбоэмболические нарушения как во время, так и после окончания лечения гонадотропином. Следует отметить, что сама по себе беременность также несет повышенный риск тромбоэмболических осложнений.
Применение Менопура может привести к положительному результату допинг-теста.
Применение Менопура как допинга может ухудшить состояние здоровья.
Препарат содержит лактозу, поэтому его не следует применять пациентам с редкими наследственными формами непереносимости галактозы, недостаточностью лактазы или синдромом глюкозо-галактазной мальабсорбции.
Применение в период беременности или кормления грудью
Менопур противопоказан в период беременности и кормления грудью.
Дети
Не назначают детям.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
Не влияет.
Передозировка
Симптомы: возможно развитие синдрома гиперстимуляции яичников. Лечение симптоматическое.
В случае легкой степени гиперстимуляции (степень I), которая сопровождается незначительным увеличением яичников (размер яичников 5-7 см), избыточной секрецией стероидных гормонов и болью в животе, нет необходимости принимать специальные меры предосторожности. Необходимо проинформировать пациентку о причинах этого состояния и проводить за ней тщательное наблюдение.
При степени гиперстимуляции II с образованием кист яичников (размер яичников 8-10 см), которая сопровождается болью в животе, тошнотой и рвотой, необходимо провести тщательное клиническое обследование, а в случае высокого уровня гемоглобина возможно будет необходимо замещение циркулирующей крови с помощью внутривенных вливаний.
При степени гиперстимуляции III с образованием больших кист яичников (размер яичников больше 10 см), которая сопровождается асцитом, гидротораксом, вздутием живота, болью в животе, диспноэ, задержкой соли в организме, повышением уровня гемоглобина, повышенной вязкостью крови, агрегацией тромбоцитов с риском тромбоэмболических осложнений необходима срочная госпитализация.
Форма выпуска и упаковка
По 75 МЕ фолликулостимулирующего гормона и 75 МЕ лютеинизирующего гормона в бесцветные стеклянные флаконы с резиновой пробкой, обжатые алюминиевыми колпачками, с предохранительной крышкой из пластмассы голубого цвета.
По 1 мл растворителя в бесцветные стеклянные ампулы из стекла типа I, с цветной контрольной точкой.
На флаконы и ампулы наклеивают этикетки самоклеющиеся.
По 5 флаконов с препаратом и 5 ампул с растворителем упаковывают в контурную ячейковую упаковку.
По 1 или 2 контурной упаковке вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Условия хранения
Хранить при температуре не выше 25º С в защищенном от света месте.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Приготовленный раствор использовать сразу после разведения.
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель и держатель регистрационного удостоверения:
Ферринг ГмбХ, Германия
Wittland 11,24109 Kiel, Germany
Наименование, адрес и контактные данные организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств от потребителей и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства
Представительство «Ферринг Фармацевтикалс С.А.» в Республике Казахстан
Республика Казахстан, г. Алматы, 050000, Алмалинский район
ул. Наурызбай батыра, д. 99/1, офис 41б.
Тел./факс: +7(727) 311-54-47
МЕНОПУР (менотропин)
УТВЕРЖДЕНА
Приказом председателя
Комитета Фармации
Министерства здравоохранения
Республики Казахстан
от «17» 05 2018 г.
№ N015075, N015076
Инструкция по медицинскому применению лекарственного средства
Менопур
Торговое название
Менопур
Международное непатентованное название
Нет
Лекарственная форма
Порошок лиофилизированный для приготовления раствора для инъекций 600 МЕ, 1200 МЕ в комплекте с растворителем
Состав
Один флакон содержит
Менопур 600 МЕ
активное вещество - менотропин высокоочищенный (человеческий менопаузальный гонадотропин, содержащий 600 МЕ ФСГ (фолликулостимулирующего гормона) и 600 МЕ ЛГ (лютеинизирующего гормона))
Менопур 1200 МЕ
активное вещество - менотропин высокоочищенный (человеческий менопаузальный гонадотропин, содержащий 1200 МЕ ФСГ (фолликулостимулирующего гормона) и 1200 МЕ ЛГ (лютеинизирующего гормона))
вспомогательные вещества: лактозы моногидрат, динатрия гидрофосфат гептагидрат, полисорбат 20, 1 М раствор кислоты фосфорной, 0.5 М раствор натрия гидрофосфата гептагидрата.
растворитель: м-крезол, вода для инъекций.
Описание
Белый или почти белый лиофилизированный порошок в виде коржа.
Растворитель: Прозрачный бесцветный раствор.
Фармакотерапевтическая группа
Препараты для лечения заболеваний урогенитальных органов и половые гормоны. Половые гормоны и модуляторы половой системы. Гонадотропины и другие стимуляторы овуляции. Гонадотропины. Гонадотропин менопаузальный.
Код АТХ G03GA02
Фармакологические свойства
Фармакокинетика
Биодоступность менотропина выше после подкожного введения, чем после внутримышечного введения. После внутримышечного введения 300 МЕ ФСГ и 300 МЕ ЛГ полученные значения составляют: AUC0-¥ = 320,1 мМЕ/мл/ч, Cmax = 4,15 мМЕ/мл, tmax= 18 ч; после подкожного введения AUC0- = 385,2 мМЕ/мл х ч, Cmax = 5,62 мМЕ/мл, tmax= 12 ч. Период полувыведения составляет 56 ч после внутримышечного введения и 51 ч после подкожного введения. Менотропин выводится преимущественно почками.
Фармакокинетика у особых групп пациентов:
Фармакокинетика препарата «Менопур» у пациентов с почечной или печеночной недостаточностью не изучена.
Фармакодинамика
Менопур является препаратом человеческого менопазуального гонадотропина высокой степени очистки. Препарат содержит фолликулостимулирующий (ФСГ) и лютеинизирующий гормоны (ЛГ) в соотношении 1:1, по 600 МЕ или по 1200 МЕ ФСГ и ЛГ, которые вырабатываются гипофизом человека. Действующее вещество получают из мочи женщин в постменопаузальном периоде. Менотропин, обладающий ФСГ и ЛГ активностью, индуцирует рост и созревание фолликулов, а также гонадную секрецию стероидов у женщин, не страдающих первичной недостаточностью яичников. ФСГ запускает фолликулярный рост на стадии раннего фолликулогенеза, а ЛГ участвует в овариальном стероидогенезе и в физиологических процессах, приводящих к развитию предовуляторного фолликула.
Показания к применению
Стимуляция созревания фолликулов при бесплодии.
Монофолликулярная стимуляция
- гипо- или нормогонадотропная аменорея, олигоменорея
- ановуляторные циклы и недостаток лютеиновой фазы у женщин, которые оказались нечувствительными к лечению кломифеном
Мультифолликулярная стимуляция
- контролируемая суперовуляция яичников с целью индукции множественного роста фолликулов при проведении вспомогательных репродуктивных технологий (ВРТ)
Способ применения и дозы
Лечение препаратом Менопур должно проводиться под наблюдением врача.
Препарат вводят подкожно или внутримышечно после растворения в прилагаемом растворителе.
Приготовленный раствор предназначен для многократного применения и может храниться в течение 28 дней.
Режимы дозирования, описанные ниже, аналогичны как для подкожного, так и для внутримышечного введения.
Доза препарата подбирается индивидуально, в зависимости от реакции яичников, и корригируется по результатам ультразвукового исследования яичников и уровня эстрадиола в крови.
Менопур может применяться как отдельно, так и в комбинации с агонистом или антагонистом гонадотропин-рилизинг-гормона (ГнРГ).
Длительность лечения зависит от индивидуальных особенностей пациентки и от применяемого протокола лечения.
Монофолликулярная стимуляция
Применение Менопура следует начинать в течение первых 7 дней менструального цикла. Рекомендуемая начальная доза составляет 75 МЕ в день (или 150 МЕ каждые 2 дня). Дальнейший режим лечения следует подбирать индивидуально, основываясь на результаты клинического наблюдения (включая ультразвуковое исследование яичников и\или контроль уровня эстрадиола). Лечение продолжается пока соответствующие уровни эстрогена (содержание эстрадиола в плазме – 1.1-2.9 нмол/л = 300-800 пг/мл) и соответствующее созревание фолликула (диаметр ≤18 мм) не достигнуты. В случае отсутствия результата лечение может быть отменено либо продолжено в увеличенной дозировке, но делать это не чаще одного раза в течение 7 дней. Рекомендованное одноразовое увеличение дозы составляет 37,5 МЕ, но не более 75 МЕ. Максимальная суточная доза препарата не должна превышать 225 МЕ. Курс лечения длится 7 - 12 дней максимум. Если уровень плазменного эстрогена повышается слишком быстро (более 100% в 2-3 дня), доза Менопура должна быть уменьшена. Если Менопур применяется в комбинации с ФСГ, доза Менопура должна быть уменьшена соответственно.
При достижении оптимального результата ввести разовую дозу хорионического гонадотропного гормона (ХГГ) от 5000 до 10000 МЕ на следующий день после последней введенной дозы Менопура. Пациентке рекомендуется иметь половые контакты в день введения ХГГ и на следующий день. Альтернативным способом является проведение искусственного внутриматочного оплодотворения. Пациентка должна находиться под тщательным наблюдением на протяжении 2-х недель после введения ХГГ.
Если наблюдается чрезмерная реакция на применение Менопура, курс лечения необходимо прекратить и не вводить ХГГ. Пациентка должна использовать барьерный метод контрацепции или отказаться от половых контактов до начала следующих менструальных кровотечений.
Мультифолликулярная стимуляция
Для пациентов, которые прошли курс лечения с применением агониста ГнРГ, лечение Менопуром следует начинать приблизительно через 2 недели после начала лечения агонистом. Рекомендованная суточная доза Менопура составляет 150-225 МЕ на протяжении, минимум, первых 5 дней лечения.
Основываясь на клинических наблюдениях (включая ультразвуковое исследование и\или контроль уровня эстрадиола), последующее дозирование должно быть индивидуальным, но не превышать 150 МЕ, максимальная суточная доза – 450 МЕ. Длительность лечения не должна превышать 20 дней.
При использовании протоколов, не предусматривающих десенсибилизацию с применением агонистов ГнРГ, терапию с применением Менопура следует начинать на 2-3 день менструального цикла. Рекомендованная доза и режим дозирования Менопура такие же, как для протоколов с применением агонистов ГнРГ.
При достижении оптимальной реакции организма вводится разовая доза от 5000 до 10000 МЕ хорионического гонадотропного гормона (ХГГ) для индукции окончательного созревания фолликула и подготовки к выходу ооцита. Овуляция наступает 32-48 часов спустя. Пациентке рекомендуется иметь ежедневные половые контакты со дня введения ХГГ к ожидаемому времени овуляции. Пациентка должны находиться под тщательным наблюдением на протяжение 2 недель после введения ХГГ.
Если наблюдается чрезмерная реакция на применение Менопура, курс лечения необходимо прекратить и отменить введение ХГГ. Пациентка должна использовать барьерный метод контрацепции или отказаться от половых контактов до начала следующих менструальных кровотечений.
Приготовление раствора
Порошок следует разводить только тем растворителем, который находится в упаковке. Присоедините иглу для разведения к предварительно заполненному шприцу с растворителем. Введите весь растворитель во флакон с порошком. Порошок должен быстро раствориться до получения прозрачного раствора. В противном случае осторожно вращайте флакон до получения прозрачного раствора. Следует избегать интенсивного встряхивания. Нельзя использовать непрозрачный раствор или раствор, содержащий видимые частицы.
Шприцы для введения градуированы в единицах от 37,5 до 600 МЕ ФСГ и ЛГ. Отберите назначенную дозу препарата в шприц для введения и сразу введите. 1 мл раствора содержит 600 МЕ ФСГ и ЛГ.
Во избежание ошибки при использовании, пациенты должны быть четко проинформированы о том, что многодозовый состав препарата «Менопур» 600 МЕ и «Менопур» 1200 МЕ рассчитан для многоразовых инъекций.
Побочные действия
Наиболее часто сообщаемые неблагоприятные явления во время лечения препаратом «Менопур» включают боль в области живота, головную боль, реакции в месте введения и болезненность в месте введения, а также вздутие живота. Ниже указаны основные побочные явления у женщин во время лечения препаратом «Менопур» в рамках клинических исследований и пост-маркетинговые наблюдения с учетом системно-органного класса (СОК) и частоты (часто: ≥1%, <10%; периодически: ≥0,1%, <1%; редко: ≥0,01%, <0,1%; очень редко: <0,01%, неизвестно: на основании, преимущественно, спонтанных сообщений в рамках изучения рынка, невозможно определить точную частоту).
Со стороны иммунной системы:
Очень редко: аллергические реакции (локализованные или генерализованные)
Со стороны обмена веществ и питания:
Неизвестно: увеличение веса
Со стороны нервной системы
Часто: головная боль
Иногда: головокружение
Со стороны органов зрения:
Неизвестно: нарушение зрения.
Со стороны сердца и сосудов:
Редко: венозная и артериальная тромбоэмболия, как например, тромбоз глубоких вен или легочная эмболия (в основном в сочетании с тяжелым СГЯ)
Со стороны желудочно – кишечного тракта:
Часто: боль в области живота, тошнота, вздутие живота.
Иногда: рвота, дискомфорт в желудке, диарея.
Нарушения со стороны кожи и подкожных тканей
Редко: акне, сыпь
Неизвестно: зуд, крапивница.
Со стороны скелетной мускулатуры и соединительной ткани:
Неизвестно: мышечноскелетная боль.
Со стороны репродуктивной системы:
Часто: тазовая боль, набухание груди, увеличение яичников, кисты яичников, многоплодная беременность, гиперстимуляция яичников от легкой до умеренной степени
Редко: гиперстимуляция яичников тяжелой степени (смотреть «Предостережения и меры предосторожности»)
Неизвестно: перекрут яичника.
Общие побочные явления и неблагоприятные реакции в месте введения:
Часто: местные реакции в месте введения (к примеру, боль), симптомы по типу гриппа, например, жар и суставная боль.
Иногда: утомляемость.
Неизвестно: пирексия, чувство дискомфорта.
Активное вещество данного препарата выделяется из мочи человека. Риск передачи патогенных организмов известной и неизвестной природы, соответственно невозможно полностью контролировать.
Противопоказания
- гиперчувствительность к действующему веществу или любому из вспомогательных веществ
- опухоли гипофиза или гипоталамуса, гиперпролактинемия
- экстрагенитальная эндокринопатия, обусловленная тяжелыми заболеваниями щитовидной железы и надпочечников
- карцинома яичников, матки или молочных желез
- гинекологические кровотечения неустановленной этиологии
- киста яичников или увеличение яичников, не связанное с синдромом поликистозных яичников
- беременность и период лактации
- детский и подростковый возраст до 18 лет
- первичная несостоятельность яичников
- аномалии половых органов, несовместимые с беременностью
- фиброзные новообразования матки, несовместимые с беременностью
- бесплодие без нарушения нормального созревания фолликулов (за исключением пациентов, которые участвуют в программах вспомогательных репродуктивных технологий (ВРТ))
Лекарственные взаимодействия
Не смешивать с другими лекарственными средствами. Несмотря на отсутствие клинического опыта, предполагается, что одновременное применение Менопура и кломифена цитрата может усиливать реакцию фолликулярного созревания. При совместном применении Менопура с агонистами ГнРГ с целью гипофизарной десенсибилизации могут понадобиться более высокие дозы Менопура для достижения желаемой реакции со стороны яичников.
Менопур может применяться в сочетании с препаратом Бравель (урофоллитропин (ФСГ)). Исследования показали, что совместное введение этих препаратов не влияет на их биодоступность.
Менопур может применяться в сочетании с препаратом Хорагон (человеческий хорионический гонадотропин, чХГ) для лечения женщин с целью индукции овуляции после стимуляции фолликулярного роста.
Особые указания
Менопур должен применяться исключительно под наблюдением специалиста, специализирующегося на лечении бесплодия.
Прежде чем начать лечение, необходимо провести исследование причин бесплодия у обоих партнеров, а также провести медицинское обследование относительно наличия возможных противопоказаний. В частности, пациенток необходимо обследовать на наличие гипотиреоидизма, адренокортикальной недостаточности, гиперпролактинемии, гипофизарной или гипоталамической опухоли, назначить соответствующее лечение, предусмотренное при этих патологических состояниях. Перед началом лечения бесплодия у женщин следует оценить функциональное состояние яичников (ультразвуковая диагностика и уровень эстрадиола в крови). Первая инъекция Менопура должна быть проведена под тщательным контролем врача. У пациенток, которым проводится стимуляция роста фолликулов, может наблюдаться увеличение размера яичников или развиваться синдром гиперстимуляции яичников (СГЯ). Соблюдение рекомендуемого режима дозирования Менопура и тщательный контроль за реакцией яичников помогут минимизировать риск развития этих побочных эффектов.
Синдром гиперстимуляции яичников (СГЯ)
СГСЯ представляет собой клиническое явление, отличающееся от неосложненного увеличения яичников, и может проявиться с возрастанием степени тяжести. Признаки СГСЯ включают: увеличение яичников, высокие сывороточные уровни половых гормонов и увеличение проницаемости сосудов, которое может приводить к накоплению жидкости в перитонеальной, плевральной и, в редких случаях, перикардиальной полостях.
В тяжелых случаях СГСЯ могут наблюдаться следующие симптомы: абдоминальная боль, увеличение живота, чрезмерное увеличение яичников, увеличение массы тела, одышка, олигурия и желудочно-кишечные симптомы, такие как тошнота, рвота и диарея. При клиническом обследовании могут быть выявлены: гиповолемия, сгущение крови, нарушение баланса электролитов, асцит, гемоперитонеум, плевральный выпот, гидроторакс, острая дыхательная недостаточность и тромбоэмболия. Кроме того, может произойти разрыв яичниковых кист.
Чрезмерная овариальная реакция на лечение гонадотропинами редко приводит к развитию СГСЯ до тех пор, пока для инициирования овуляции не вводится чХГ. Следовательно, в случае овариальной гиперстимуляции не следует вводить чХГ. Также нужно посоветовать пациентке воздерживаться от половых контактов или использовать барьерные методы контрацепции на протяжении не менее 4 дней. СГСЯ может очень быстро прогрессировать (от 24 часов до нескольких дней) и приобретать серьезную симптоматику. Следовательно, пациентка должна находиться под медицинским контролем в течение периода лечения и не менее 2 недель после введения чХГ.
Минимизировать риск развития овариальной гиперстимуляции и многоплодной беременности можно, придерживаясь рекомендованного дозирования и режима введения препарата Менопур, а также тщательно контролируя курс лечения. При проведении ВРТ риск развития гиперстимуляции можно снизить путем аспирации всех фолликулов перед овуляцией.
Критерии оценки чрезмерной реакции яичников:
В случае монофолликулярного возбуждения: повышение уровня эстрадиола в плазме более чем на 4000 пмол/л или 1100 пг/мл и/или более чем 3 фолликула диаметром, по крайней мере, 16 мм.
В случае мультифолликулярной стимуляции: повышение уровня эстрадиола в плазме более чем 11нмол/л или 3000 пг/мл и имеется 20 фолликулов диаметром, по крайней мере, 12 мм.
Если уровень эстрадиола превышает 20 нмол/л или 5500 пг/мл и есть, по крайней мере, 40 фолликулов, чХГ не должен быть введен.
СГСЯ может становиться более тяжелым и продолжительным в случае наступления беременности. Наиболее часто СГСЯ развивается после завершения гормонального лечения и достигает максимальной частоты приблизительно через 7-10 дней после окончания лечения. Обычно СГСЯ проходит спонтанно с началом менструаций.
В случае тяжелого СГСЯ лечение гонадотропинами следует прекратить, если оно все еще продолжается, пациентку следует госпитализировать и начать специфическое лечение СГСЯ.
Данный синдром чаще встречается у женщин с синдромом поликистозных яичников.
Многоплодная беременность
У пациенток, у которых проводится индукция овуляции с применением гонадотропинов, частота многоплодных беременностей выше, чем при естественном оплодотворении. Для минимизации риска многоплодия необходимо вести тщательное наблюдение за реакцией яичников пациентки.
У пациенток, которым проводится процедура ВРТ, риск многоплодных беременностей главным образом зависит от количества пересаженных эмбрионов, их качества и возраста пациентки.
Невынашивание
Количество случаев невынашивания беременности выше у женщин, которым проводилась стимуляция созревания фолликулов или при проведении программы ВРТ, чем в случаях естественного зачатия.
Внематочная беременность
У женщин с заболеваниями маточных труб высокий риск развития внематочной беременности не зависимо от того, наступила данная беременность в результате естественного зачатия или лечения бесплодия. Сообщалось, что после проведения ВРТ частота случаев внематочной беременности составляла 2-5 % в сравнении с 1-1,5 % случаев естественного зачатия.
Новообразования репродуктивных органов
У женщин, которые неоднократно получали медикаментозное лечение по поводу бесплодия, наблюдалось развитие как доброкачественных, так и злокачественных новообразований яичников и других органов репродуктивной системы, связь между лечением с применением гонадотропина и склонностью к новообразованиям не выяснена.
Врожденные пороки развития
Распространенность врожденных пороков развития плода у женщин после проведения ВРТ может незначительно превышать количество пороков при естественном зачатии, это может быть результатом индивидуальных особенностей родителей (например, возраст матери, характеристики спермы и т.д.).
Тромбоэмболические нарушения
У женщин с повышенным риском развития тромбоэмболических состояний ввиду наследственной предрасположенности, ожирением (индекс массы тела > 30 кг/м2) или тромбофилией могут развиваться венозные или артериальные тромбоэмболические нарушения как во время, так и после окончания лечения гонадотропином. Следует отметить, что сама по себе беременность также несет повышенный риск тромбоэмболических осложнений.
Особенности влияния на способность управлять транспортным средством или потенциально опасными механизмами
Не влияет.
Передозировка
Симптомы: возможно развитие синдрома гиперстимуляции яичников (СГЯ).
Лечение: При легкой степени СГЯ специфического лечения не требуется. Пациентка должна находиться под тщательным медицинским контролем. При средней степени СГЯ показан клинический мониторинг и симптоматическое лечение, при необходимости внутривенное введение кровозаменителей с высокой гемоконцентрацией. При тяжелой степени СГЯ необходима обязательная госпитализация, поскольку в таких случаях могут развиться состояния, угрожающие жизни, требующие интенсивного медицинского вмешательства.
Форма выпуска и упаковка
Препарат, содержащий 600 МЕ/1200 МЕ фолликулостимулирующего гормона и 600 МЕ /1200 МЕ лютеинизирующего гормона, помещен в бесцветный стеклянный флакон.
По 1 мл растворителя в предварительно заполненном шприце.
1 флакон с препаратом и 1 шприц с растворителем, 1 игла для разведения вложены в пластиковую ячейковую упаковку (запечатанная прозрачной пленкой или с пластиковой крышкой). Отдельно 9 шприцев для введения и 9 спиртовых салфеток вложены в картонную ячейковую упаковку и обвернуты пленкой. 1 пластиковая ячейковая упаковка и 1 картонная ячейковая упаковка вместе с инструкцией по медицинскому применению на государственном и русском языках вложены в картонную коробку (для дозировки 600 МЕ).
1 флакон с препаратом и 2 шприца с растворителем, 1 игла для разведения вложены в пластиковую ячейковую упаковку (запечатанная прозрачной пленкой или с пластиковой крышкой). Отдельно 18 шприцев для введения и 18 спиртовых салфеток вложены в картонную ячейковую упаковку и обвернуты пленкой. 1 пластиковая ячейковая упаковка и 1 картонная ячейковая упаковка вместе с инструкцией по медицинскому применению на государственном и русском языках вложены в картонную коробку (для дозировки 1200 МЕ).
Условия хранения
Хранить при температуре 2 - 8 °С в оригинальной упаковке. Не замораживать.
Разведенный препарат можно хранить в течение 28 дней при температуре не выше 25 °С.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
«Ферринг ГмбХ», Германия
Wittland 11, 24109 Kiel, Germany
Держатель регистрационного удостоверения и упаковщик
«Ферринг Интернешнл Сентер СА», Швейцария
Chemin de la Vergognausaz 50,1162 St-Prex,Switzerland
Адрес организации на территории Республики Казахстан, принимающей на территории Республики Казахстан претензии (предложения) от потребителей по качеству лекарственного средства и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства
Представительство «Ферринг Фармацевтикалс С.А.» в Республике Казахстан
Республика Казахстан, г. Алматы, 050022, Алмалинский район
ул. Наурызбай батыра, д. 99/1, офис 41б.
Тел./факс: +7(727) 311-54-47
РЕКОВЕЛЛЬ (фоллитропин дельта)
УТВЕРЖДЕНА
Приказом председателя
Комитета Фармации
Министерства здравоохранения
Республики Казахстан
от «____»_____________201__ года
№ ___________________
Инструкция по медицинскому применению лекарственного средства
Рековелль
Данный лекарственный препарат подлежит дополнительному мониторингу. Это позволит быстро выявить новую информацию по безопасности. Мы обращаемся к работникам системы здравоохранения с просьбой сообщать о любых подозреваемых нежелательных реакциях.
Торговое название
Рековелль
Международное непатентованное название
Фоллитропин дельта
Лекарственная форма
Раствор для инъекций, 12 мкг/0.36 мл, 36 мкг/1.08 мл и 72 мкг/2.16 мл
Состав
1 картридж с раствором содержит
активное вещество- фоллитропин дельта (рекомбинантный) 12,0 мкг, 36,0 мкг или 72,0 мкг;
вспомогательные вещества: фенол, полисорбат-20, L-метионин, натрия сульфат декагидрат, динатрия гидрофосфат додекагидрат, кислота фосфорная, натрия гидроксид, вода для инъекций
Описание
Прозрачный бесцветный раствор, без видимых механических включений.
Фармакотерапевтическая группа
Половые гормоны и модуляторы половой системы. Гонадотропины и другие стимуляторы овуляции. Гонадотропины. Фоллитропин дельта.
Код АТХ G03GA10
Фармакологические свойства
Фармакокинетика
Всасывание при ежедневном подкожном введении максимальная концентрация фоллитропина дельта достигается примерно через 10 ч. Абсолютная биодоступность составляет около 64%.
Распределение после подкожного введения кажущийся объем распределения составляет около 25 л, а при внутривенном введении объем распределения 9 л (при достижении равновесной концентрации). В терапевтическом диапазоне выраженность системного действия фоллитропина дельта прямо пропорциональна введенной дозе препарата.
Выведение фоллитропин дельта, предположительно, выводится в основном почками, как и другие фоллитропины. В неизменном виде с мочой выводится около 9% действующего вещества. При однократном подкожном введении фоллитропина дельта период полувыведения составляет около 40 ч, при последующих подкожных введениях – около 28 ч. При подкожном введении кажущийся клиренс препарата составляет 0,6 л/ч, а при внутривенном введении – 0,3 л/ч. В связи с выраженным системным действием при последующих введениях препарата наблюдается низкий кажущийся клиренс около 0,6 л/ч, приводящий к высокой эффективности.
Фармакодинамика
Рековелль – рекомбинантный фолликулостимулирующий гормон человека (ФСГ), является препаратом, стимулирующим рост и развитие фолликулов. При парентеральном введении ФСГ наблюдается образование множественных зрелых фолликулов. Аминокислотная последовательность двух субъединиц фоллитропина идентична последовательности аминокислот в эндогенном ФСГ человека. Синтез фоллитропина дельта осуществляется с использованием клеток человека линии PER.C6, поэтому профиль гликозилирования отличен от фоллитропина альфа и фоллитропина бета.
При проведении теста Steelman-Pohley у крыс in vivo при ежедневном введении препарата Рековелль и фоллитропина альфа, используемых в эквивалентных дозах, выраженных в единицах действия (МЕ), более выраженный ответ яичников наблюдался у особей, получавших препарат Рековелль (ответ яичников оценивался по концентрации эстрадиола, ингибина В и размеру фолликулов). Поскольку данный тест не позволяет дать полную оценку биологической активности препарата, дозировка препарата Рековелль приводится в микрограммах, а не в единицах действия (МЕ).
При увеличении дозы препарата Рековелль и концентрации антимюллерова гормона (АМГ) в сыворотке крови число созревших фолликулов увеличивается. Наоборот, при большой массе тела число созревших фолликулов уменьшается (имеет клиническое значение только при применении фоллитропина дельта в дозировке ниже 12 мкг).
Показания к применению
Контролируемая гиперстимуляция яичников с целью индукции роста множественных фолликулов при проведении следующих вспомогательных репродуктивных технологий (ВРТ): экстракорпоральное оплодотворение (ЭКО) или интрацитоплазматическая инъекция спермы (ИКСИ).
Способ применения и дозы
Лечение препаратом Рековелль следует проводить только под контролем врача, имеющего соответствующую специализацию и опыт лечения бесплодия. Доза препарата указывается в микрограммах. Подобранная схема лечения является индивидуальной и не может быть использована при лечении прочими гонадотропинами.
В первом цикле терапии суточная доза препарата определяется на основании концентрации антимюллерова гормона (АМГ) в сыворотке крови и массы тела пациентки. При подборе дозы необходимо взять за основу последнее значение АМГ (за предшествующие 12 месяцев). На протяжении первого цикла лечения дозировка препарата не должна меняться.
У женщин с уровнем АМГ < 15 пмоль/л независимо от массы тела суточная доза составляет 12 мкг. При концентрации АМГ ≥ 15 пмоль/л суточная доза фоллитропина дельта варьирует в диапазоне 0,10 – 0,19 мкг/кг массы тела с учетом концентрации АМГ (см. Табл. 1). Для соответствия рассчитанной дозировки препарата шкале на шприц-ручке, возможно округление дозы до ближайших 0,33 мкг. Высшая суточная доза препарата в первом цикле лечения составляет 12 мкг.
Для определения дозы препарата Рековелль необходимо измерить массу тела пациентки (без обуви и верхней одежды) непосредственно перед началом цикла лечения.
Таблица 1
Режим дозирования
|
АМГ, пмоль/л |
< 15 |
15-16 |
17 |
18 |
19-20 |
21-22 |
23-24 |
25-27 |
28-32 |
33-39 |
≥ 40 |
|
Суточная доза |
12 мкг |
0,19 мкг/кг |
0,18 мкг/кг |
0,17 мкг/кг |
0,16 мкг/кг |
0,15 мкг/кг |
0,14 мкг/кг |
0,13 мкг/кг |
0,12 мкг/кг |
0,11 мкг/кг |
0,10 мкг/кг |
Концентрация АМГ выражается в пмоль/л и округляется до целого числа. Если значение АМГ представлено в нг/мл, необходимо перевести единицы измерения в пмоль/л путем умножения на 7,14 (нг/мл х 7,14 = пмоль/л).
Терапию препаратом Рековелль начинают на 2 или 3 день менструального цикла и продолжают вплоть до образования необходимого количества фолликулов (≥ 3 фолликулов диаметром ≥ 17 мм), и, как правило, результат достигается к 9 дню терапии (продолжительность терапии 5-20 дней). Для индукции овуляции необходимо однократное введение пациентке хорионического гонадотропина человека (чХГ) рекомбинантного, 250 мкг, или 5000 МЕ чХГ. Если у пациентки отмечается формирование большого числа фолликулов (> 25 фолликулов диаметром ≥ 12 мм) терапию препаратом Рековелль необходимо прекратить, индукция овуляции в данном случае не проводится.
При необходимости дополнительных циклов терапии суточная доза препарата Рековелль может быть сохранена или скорректирована в зависимости от выраженности реакции яичников в предыдущем цикле. Если выраженность ответа яичников в предыдущем цикле была удовлетворительной, без развития СГЯ, следует использовать препарат в аналогичной дозировке. В случае недостаточно выраженного ответа яичников в предшествующем цикле, следует увеличить дозу препарата на 25 % или 50 %, в зависимости от ответа пациента на лечение. Если в предыдущем менструальном цикле наблюдался избыточный ответ яичников, необходимо снизить дозу препарата на 20 % или 33 % в следующем цикле, в зависимости от выраженности ответа на лечение. В случае развития СГЯ в предыдущем цикле или риска возникновения СГЯ необходимо уменьшить суточную дозу на 33 % в последующем цикле. Высшая суточная доза препарата 24 мкг.
Препарат Рековелль предназначен для подкожного введения, предпочтительно в область передней брюшной стенки. Первую инъекцию препарата следует проводить под непосредственным наблюдением медицинского работника. Ежедневные однократные инъекции препарата рекомендуется проводить в одно и то же время, ежедневно меняя участок инъекции. Самостоятельное введение препарата могут проводить лишь должным образом обученные пациенты, которые в случае необходимости имеют возможность проконсультироваться с врачом.
Применение в особых клинических случаях
Нарушение функции почек и печени
Оценка фармакокинетики, эффективности и безопасности применения препарата у пациентов с нарушениями функции печени и/или почек не проводилась. Информация о необходимости коррекции режима дозирования препарата отсутствует.
Ановуляция, связанная с синдромом поликистозных яичников (СПКЯ)
Применение препарата Рековелль не исследовалось у пациенток с ановуляцией, связанной с СПКЯ. Клинические исследования препарата проводились у женщин с синдромом поликистозных яичников, без нарушений менструального цикла.
Пациенты пожилого возраста
Препарат не применяется у пациентов пожилого возраста в связи с отсутствием показаний.
Побочные действия
Часто (≥ 1/100 до <1/10)
головная боль
тошнота
боль в области таза, боль в области придатков матки, дискомфорт в области таза, синдром гиперстимуляции яичников (СГЯ)
повышенная утомляемость
При повторных циклах лечения частота возникновения вышеперечисленных реакций снижается.
Нечасто (≥ 1/1000 до <1/100)
эмоциональная лабильность
сонливость, головокружение
абдоминальный дискомфорт, диарея, рвота, запор
вагинальное кровотечение, дискомфорт в молочных железах (чувствительность, боль и нагрубание молочных желез).
Проведение контролируемой гиперстимуляции яичников связано с высоким риском развития СГЯ. Редко при СГЯ развиваются перекрут яичника и тромбоэмболические осложнения.
При приеме гонадотропинов возможно развитие иммуногенности с образованием антител к ФСГ.
Противопоказания
- повышенная чувствительность к действующему веществу или любому из вспомогательных веществ препарата;
- опухоли гипофиза или гипоталамуса;
- рак яичников, матки или молочной железы;
- вагинальное кровотечение неясной этиологии;
- наличие кист или увеличение размера яичников, не связанных с синдромом поликистозных яичников;
- первичная недостаточность функции яичников;
- аномалии развития половых органов, несовместимые с беременностью;
- миома матки, несовместимая с беременностью;
- детский возраст до 18 лет;
- беременность и период грудного вскармливания.
Лекарственные взаимодействия
Исследования по лекарственным взаимодействиям препарата Рековелль не проводились. В процессе терапии препаратом Рековелль не сообщалось о клинически значимых взаимодействиях с другими лекарственными препаратами.
Особые указания
Препарат Рековелль обладает выраженной гонадотропной активностью, в связи с чем при приеме препарата могут развиваться нежелательные реакции от легкой до тяжелой степени тяжести. Лечение должно проводиться под наблюдением врача, имеющего опыт диагностики и лечения бесплодия!
Применение гонадотропинов требует присутствия квалифицированного медицинского персонала, а также соответствующего оборудования. Перед назначением препарата Рековелль и в процессе лечения следует контролировать состояние яичников.Необходимо применять препарат в индивидуально подобранной дозе, отвечающей целям лечения. Выраженность ответа на прием фоллитропина дельта варьирует от низкой до избыточной у разных пациенток.
Схема лечения препаратом Рековелль подбирается индивидуально, для достижения ответа яичников, получения достаточного числа созревших фолликулов и снижения частоты возникновения синдрома гиперстимуляции яичников (СГЯ). Доза препарата указывается в микрограммах. Подобранная схема лечения является индивидуальной и не может быть использована при лечении прочими гонадотропинами.
Перед началом применения препарата Рековелль рекомендуется проведение диагностики причин бесплодия как у женщины, так и у ее партнера, а также установить возможные противопоказания к беременности. Перед началом лечения необходимо провести обследование женщин на наличие гипотиреоза и гиперпролактинемии, при необходимости назначают соответствующее лечение.
Проведение контролируемой стимуляции роста фолликулов может привести к увеличению яичников с развитием их гиперстимуляции. При соблюдении режима дозирования в сочетании с мониторингом проводимой терапии возможно минимизировать риск возникновения вышеуказанных реакций.
Синдром гиперстимуляции яичников (СГЯ)
При контролируемой гиперстимуляции может возникать увеличение яичников. Такая реакция более характерна для пациенток с синдромом поликистозных яичников и у большинства проходит самостоятельно, без дополнительного лечения.
СГЯ – синдром, отличный от неосложненного увеличения яичников, проявления которого зависят от степени тяжести. Он включает в себя значительное увеличение яичников, высокую концентрацию эстрогенов в плазме крови, а также увеличение проницаемости сосудов, что может привести к накоплению жидкости в брюшной, плевральной и, реже, перикардиальной полости.
Для снижения риска развития СГЯ необходимо проводить тщательный и частый мониторинг созревания фолликулов. В тяжелых случаях СГЯ возможны следующие симптомы: боль в животе, вздутие живота, значительное увеличение яичников, увеличение массы тела, одышка, олигурия и желудочно-кишечные симптомы, включая тошноту, рвоту и диарею. При клиническом обследовании возможно выявление гиповолемии, гемоконцентрации, электролитных нарушений, асцита, гемоперитонеума, экссудативного плеврита, гидроторакса, острого респираторного дистресс-синдрома. Очень редко тяжелый СГЯ может осложняться перекрутом яичника или тромбоэмболическими осложнениями, такими как тромбоэмболия легочной артерии, ишемический инсульт или инфаркт миокарда.
Чрезмерная реакция яичников на введение гонадотропинов редко приводит к развитию СГЯ, если не вводится чХГ с целью стимуляции овуляции. СГЯ может быть более тяжелым и затяжным при развитии беременности. Поэтому в случае гиперстимуляции яичников не следует вводить чХГ, а пациентку следует предупредить о необходимости воздерживаться от половых контактов или использовать барьерные методы контрацепции не менее 4 дней. СГЯ может быстро прогрессировать (в течение от 24 ч до нескольких дней), становясь серьезным медицинским осложнением. Наиболее часто СГЯ развивается после завершения гормональной терапии, позднее развитие СГЯ возможно вследствие гормональных изменений при беременности. Поэтому необходимо тщательное наблюдение за пациентками, по крайней мере, в течение не менее 2-х недель после окончательного созревания фолликулов.
Тромбоэмболические осложнения
Женщины с недавно диагностированными или имеющие на момент терапии тромбоэмболические заболевания или женщины с известными факторами риска развития тромбоэмболических осложнений, таких как индивидуальная или семейная предрасположенность, ожирение (ИМТ > 30 кг/м2) или тромбофилия, могут иметь повышенный риск венозных или артериальных тромбоэмболических осложнений во время или после лечения гонадотропинами. В таких случаях польза их применения должна быть сопоставлена с возможным риском. Следует учитывать, что сама беременность также повышает риск развития тромбоэмболических осложнений.
Перекрут яичника
При проведении ВРТ описаны случаи развития перекрута яичника. Причиной перекрута яичника могут быть СГЯ, беременность, проведенные ранее хирургические вмешательства на брюшной полости, перекрут яичника, киста яичника или СПКЯ в анамнезе. Повреждения яичника вследствие нарушения притока крови могут быть уменьшены при своевременной диагностике и проведении экстренной деторсии яичника.
Многоплодная беременность
При многоплодной беременности отмечается повышенный риск неблагоприятных материнских и перинатальных исходов.
В случае проведения ВРТ вероятность возникновения многоплодной беременности зависит от числа введенных эмбрионов, их качества и возраста пациентки. В редких случаях отмечались случаи беременности двойней даже при переносе одного эмбриона.
Пациентка должна быть предупреждена о потенциальном риске многоплодной беременности до начала лечения.
Осложнения беременности
Частота самопроизвольных абортов (внутриутробная гибель плода) при беременности у пациенток, которым проводится контролируемая стимуляция яичников в рамках программ ВРТ, выше, чем у здоровых женщин.
Эктопическая беременность
У пациенток с заболеваниями маточных труб в анамнезе, как при естественном зачатии, так и при лечении бесплодия, имеется высокий риск возникновения эктопической беременности. Распространенность внематочной беременности после ВРТ выше по сравнению с общей популяцией.
Новообразования органов репродуктивной системы
Имеются сообщения о новообразованиях яичников и других органов репродуктивной системы, как доброкачественных, так и злокачественных, у женщин, которые подверглись нескольким схемам введения препаратов для лечения бесплодия. В настоящее время не установлено, увеличивает ли лечение гонадотропинами исходный риск этих опухолей у женщин с бесплодием.
Врожденные пороки развития
Распространенность врожденных пороков развития плода при использовании ВРТ несколько выше, чем при естественном зачатии. Считается, что это может быть связано с индивидуальными особенностями родителей (возрастом матери, характеристиками спермы) и многоплодной беременностью.
Нарушение функции печени и почек
Информация о применении препарата у пациентов с нарушениями функции печени или почек средней или тяжелой степени тяжести отсутствует.
Содержание натрия
Препарат Рековелль практически не содержит натрий (менее 1 ммоль натрия (23 мг) на дозу).
Особенности влияния на способность управлять транспортным средством или потенциально опасными механизмами
Исследования влияния фоллитропина дельта на способность управлять транспортными средствами и механизмами не проводились. Маловероятно, что препарат Рековелль оказывает отрицательное воздействие на способность управлять транспортными средствами и другими механизмами.
Передозировка
Случаи передозировки при приеме препарата Рековелль неизвестны, однако в таких ситуациях может наблюдаться развитие синдрома гиперстимуляции яичников (СГЯ).
Подробнее см. pаздел "Особые указания".
Форма выпуска и упаковка
Раствор для инъекций для подкожного введения в предварительно заполненных шприц-ручках, 12 мкг/0.36 мл, 36 мкг/1.08 мл, 72 мкг/2.16 мл
По 0.36 мл или 1.08 мл, или 2.16 мл препарата в картридж из бесцветного стекла типа I, объемом 3 мл. Картридж установлен в пластиковую мультидозовую одноразовую шприц-ручку для многократных инъекций.
По 1 мультидозовой пластиковой одноразовой шприц-ручке для многократных инъекций и 3 иглы для инъекций (для дозировки 12 мкг/0.36 мл) или по 1 мультидозовой пластиковой одноразовой шприц-ручке для многократных инъекций и 6 игл для инъекций (для дозировки 36 мкг/1.08мл), или по 1 мультидозовой пластиковой одноразовой шприц-ручке для многократных инъекций и 9 игл для инъекций (для дозировки 72 мкг/2.16 мл) с инструкцией по медицинскому применению на государственном и русском языках помещают в картонную упаковку.
Условия хранения
В оригинальной упаковке при температуре от 2 оС до 8 оС, в защищенном от света месте. Не замораживать.
После первого использования препарат может храниться при температуре до 25 °С, без повторного охлаждения не более 28 суток. Картридж должен оставаться в шприц-ручке. По истечении указанного срока препарат должен быть утилизирован.
Хранить в недоступном для детей месте.
Срок хранения
3 года.
Не применять по истечении срока годности.
Условия отпуска
По рецепту
Производитель
Vetter Pharma-Fertigung GmbH & Co. KG, Германия
Schutzenstrasse 87, und 99-101, 88212 Ravensburg, Germany
Наименование и страна держателя регистрационного удостоверения
Ferring Pharmaceuticals A/S, Дания
Kay Fiskers Plads 11, 2300 Copenhagen S, Denmark
Упаковщик
Ferring Controlled Therapeutics Limited, Великобритания
1 Redwood Place, Peel Park Campus, East Kilbride, Glasgow, G74 5 PB, UK
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств от потребителей и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства
Представительство «Ферринг Фармацевтикалс СА» в Республике Казахстан
Республика Казахстан
г. Алматы, 050022, ул. Наурызбай батыра, д.99/1, н.п. 41Б
Тел./факс: (727) 311-54–47
РЕКОМЕНДАЦИИ ПРИ САМОСТОЯТЕЛЬНОМ ВВЕДЕНИИ ПРЕПАРАТА
Предварительно заполненная шприц-ручка с препаратом Рековелль:
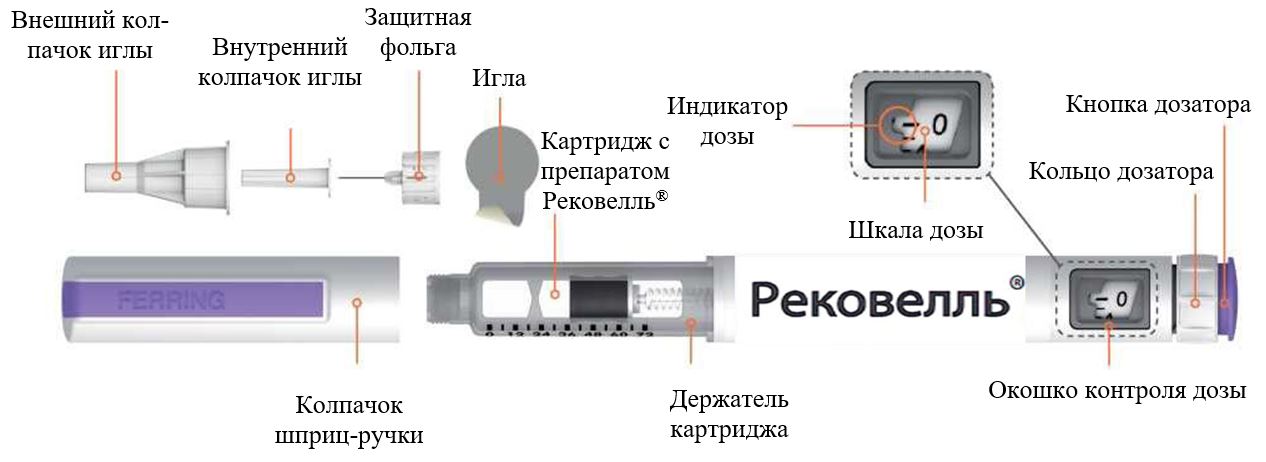
Если пациент вводит препарат Рековелль самостоятельно, ему необходимо внимательно ознакомиться и следовать инструкциям, приведенным ниже:
Общие рекомендации
Препарат предназначен для подкожного введения. Первую инъекцию препарата следует проводить под непосредственным наблюдением медицинского работника.
Ежедневные инъекции препарата рекомендуется проводить в одно и то же время, ежедневно меняя участок инъекции.
Самостоятельное введение препарата могут проводить лишь должным образом обученные пациенты, которые в случае необходимости имеют возможность проконсультироваться с врачом.
Предварительно заполненные шприц-ручки предназначены для использования только одним пациентом.
Перед применением и при каждой смене шприц-ручки внимательно ознакомьтесь с приведенной информацией, так как неправильное использование может привести к введению дозы, отличающейся от назначенной.
Необходимо подготовить предварительно заполненную шприц-ручку с препаратом Рековелль и ввести назначенную дозу препарата, как описано ниже. Числа, отображающиеся в окошке контроля дозы, означают дозу в микрограммах или мкг.
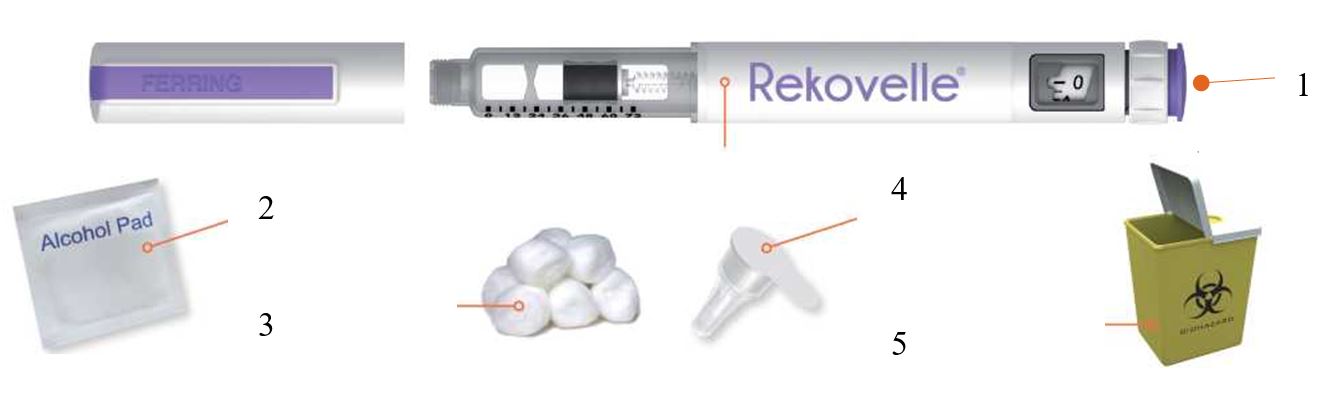
1 – предварительно заполненная шприц-ручка с препаратом Рековелль;
2 – тампон, пропитанный спиртом;
3 – стерильная марля / ватный тампон;
4 – съемная игла;
5 – контейнер для острых предметов.
2.1. Снимите колпачок со шприц-ручки.
2.2. Проверьте, что в окошке контроля установлен «0».
2.3. Подготовьте иглу к инъекции.
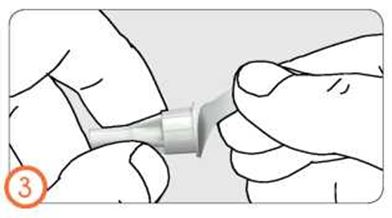
2.4. Присоедините иглу.
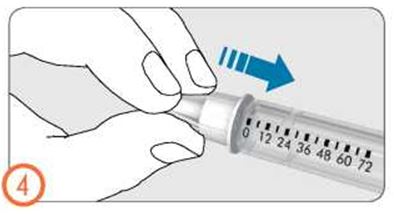
Отложите внешний колпачок – он понадобится позже.
2.5. Внимательно изучите количество жидкости, которое находится на кончике иглы, шприц-ручка специально заполнена с некоторым избытком препарата.
Предостережение: проверяйте наличие капелек только при первом использовании шприц-ручки с препаратом Рековелль для удаления воздуха из системы.
Если Вы не видите крохотных капелек жидкости при первом использовании новой ручки:
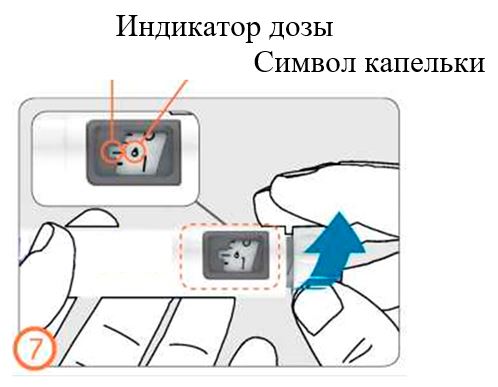
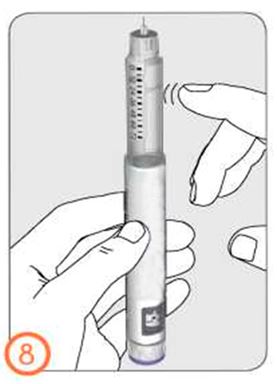
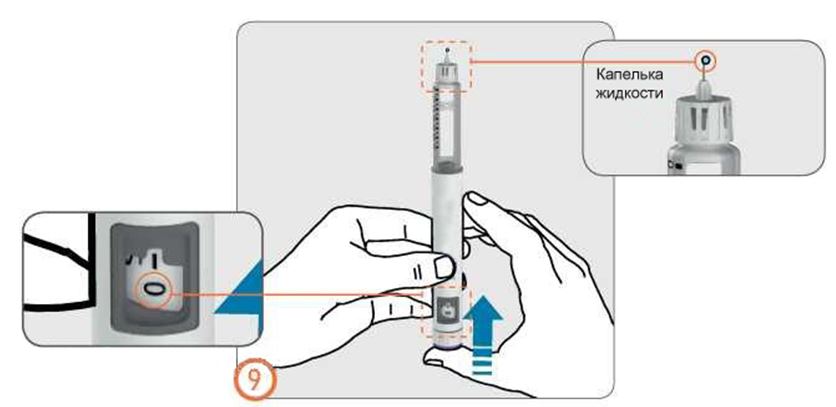
3.1. Шприц-ручка содержит 12 мкг/ 0,36 мл, 36 мкг/ 1,08 мл или 72 мкг/ 2,16 мл фоллитропина дельта.
Предварительно наполненная шприц-ручка может быть настроена для введения доз от 0,33 мкг до 20 мкг с шагом 0,33 мкг. Шкала дозы ручки промаркирована от 0 до 20 мкг. Каждое число отделено двумя линиями, каждая линия соответствует одному шагу (0,33 мкг). Поворот кольца для установки дозы сопровождается характерным щелчком, при каждом увеличении дозы чувствуется сопротивление кольца; все вышеперечисленное помогает набрать правильную дозу.
3.2. Поворачивайте кольцо дозатора до тех пор, пока не появится необходимая доза.
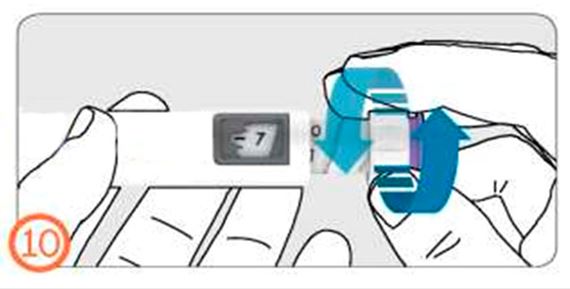
Предостережение: Перед тем, как перейти к следующему этапу, проверьте, что в окошке контроля дозы показана полная назначенная доза.
4.1. Препарат Рековелль вводится в область передней брюшной стенки. Для того, чтобы минимизировать кожные реакции, каждый день выбирайте разные места для инъекции. Не рекомендуется вводить препарат в участки с поражениями (болезненные при пальпации), ушибами, покраснениями, уплотнениями и травмами.
4.2. Протрите место для инъекции тампоном, пропитанным спиртом.
4.3. Еще раз проверьте правильность дозы, указанной в окошке.
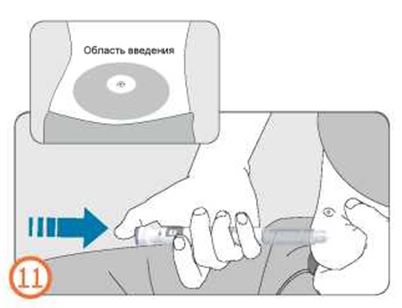
Предостережение: Если кнопка дозатора нажимается с трудом, не применяйте силу - следует заменить иглу. Если замена иглы не привела к облегчению нажатия кнопки дозатора, используйте новую шприц-ручку.
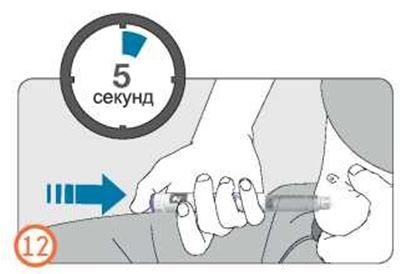
Предостережение: Не наклоняйте шприц-ручку при введении препарата, это может привести к искривлению или поломке иглы. Если игла сломана и осколок остался под кожей после введения, немедленно обратитесь за медицинской помощью.
5.1. Проверьте, что Вы ввели полную дозу.
Проверьте, что в окошке контроля дозы указан «0».
Предостережение: Если в окошке контроля дозы указано число больше 0, это значит, что шприц-ручка с препаратом Рековелль пустая и Вы не ввели полную дозу препарата.
5.2. Завершение неполной инъекции (только в тех случаях, когда требуется).
Предостережение: При раздельном введении выбрасывайте только пустую шприц-ручку.
5.3. Удаление иглы после каждой инъекции.
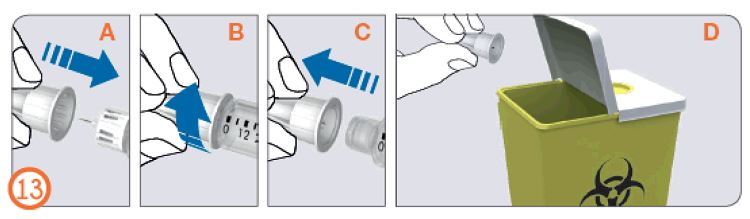
Предостережение: Надевайте на ручку колпачок после каждого использования.
5.4. Хранение предварительно заполненной шприц-ручки с препаратом Рековелль
Предостережение: Никогда не храните ручку с присоединенной иглой.
Всегда снимайте иглу с предварительно заполненной ручки с препаратом Рековелль перед тем, как надеть колпачок.
Для записи количества препарата в мкг, которое Вы вводите с каждой инъекцией, можно использовать дневник дозирования. Использование такого дневника, в котором будут записаны ежедневные инъекции, позволит Вам контролировать, вводится ли полная доза препарата каждый день.
ПРИЛОЖЕНИЕ
Приложение 1
Пример набора доз с использованием предварительно заполненной шприц-ручки с препаратом Рековелль
|
Назначенная доза |
Доза, набираемая на ручке |
Вид окошка контроля дозы |
|
0,33 |
0 и 1 линия (набрать 0 плюс 1 щелчок) |
 |
|
0,66 (промывочная доза) |
0 и 2 линии (набрать 0 плюс 2 щелчка) |
 |
|
2,33 |
2 и 1 линия (набрать 2 плюс 1 щелчок) |
 |
|
11,00 |
11 (набрать 11) |
 |
|
12,33 |
12 и 1 линия (набрать 12 плюс 1 щелчок) |
 |
|
18,66 |
18 и 2 линии (набрать 18 плюс 2 щелчка) |
 |
|
20,00 |
20 (набрать 20) |
 |
Приложение 2
Пример набора доз с использованием предварительно заполненной шприц-ручки с препаратом Рековелль
|
День лечения |
Дата |
Время |
Дозировка ручки |
Назначенная доза |
Окошко контроля дозы |
||
|
Доза для введения |
Число, отображающееся после инъекции |
||||||
|
|
|
|
12 мкг/0,36 мл |
|
|
Полная инъекция |
Если неполная, введите _____ мкг с помощью новой ручки |
|
|
|
|
12 мкг/0,36 мл |
|
|
Полная инъекция |
Если неполная, введите _____ мкг с помощью новой ручки |
|
|
|
|
12 мкг/0,36 мл |
|
|
Полная инъекция |
Если неполная, введите _____ мкг с помощью новой ручки |
|
|
|
|
12 мкг/0,36 мл |
|
|
Полная инъекция |
Если неполная, введите _____ мкг с помощью новой ручки |
Приложение 3
Пример расчета дозы при раздельном введении
|
Назначенная доза |
Доза, оставшаяся в ручке (доза, показываемая на индикаторе дозы в окне дозы) |
Доза для инъекции с использованием новой ручки (доза, показываемая на индикаторе дозы в окне дозы) |
|
11,33 |
4,00 (4) |
7,33 (7 и 1 линия (набрать 7 плюс 1 щелчок) |
|
12,66 |
12,33 (12 и 1 линия (12 плюс 1 щелчок) |
0,33 (0 и 1 линия (набрать 0 плюс 1 щелчок) |
|
11,00 |
3,00 (3) |
8,00 (8 (набрать 8) |
|
12,00 |
6,66 (6 и 2 линии (6 плюс 2 щелчка) |
Округлить 5,34 до 5,33 (5 и 1 линия (набрать 5 плюс 1 щелчок) |
|
18,33 |
8,66 (8 и 2 линии (8 плюс 2 щелчка) |
Округлить 9,67 до 9,66 (9 и 2 линии (набрать 9 плюс 2 щелчка) |
ХОРАПУР (гонадотропин хорионический)
УТВЕРЖДЕНА
Приказом Председателя
Комитета Фармации
Министерства здравоохранения
Республики Казахстан
от «17» 05 2018 г.
№ N015073, N015074
Инструкция по медицинскому применению лекарственного средства
Хорапур
Торговое название
Хорапур
Международное непатентованное название
Гонадотропин хорионический
Лекарственная форма
Порошок лиофилизированный для приготовления раствора для инъекций в комплекте с растворителем
Состав:
Один флакон содержит
активное вещество – гонадотропин хорионический высокоочищенный 1 500 МЕ или 5 000 МЕ,
вспомогательные вещества: лактозы моногидрат, 1М раствор натрия гидроксида.
Одна ампула содержит
Растворитель: натрия хлорид, кислота хлороводородная 10%, вода для инъекций.
Описание
Лиофилизированная масса в виде комочка белого цвета.
Растворитель - прозрачный, бесцветный раствор.
Фармакотерапевтическая группа
Половые гормоны и модуляторы половой системы. Гонадотропины и другие стимуляторы овуляции. Гонадотропины. Гонадотропин хорионический.
Код АТХ G03GA01
Фармакологические свойства
Фармакокинетика.
ХГЧ вводится внутримышечно. Максимальный уровень ХГЧ в сыворотке достигается спустя приблизительно 10 часов (дозозависимо) с последующим снижением с периодом полувыведения приблизительно 30 часов. В результате медленного выведения ХГЧ может накапливаться в сыворотке после нескольких (например, ежедневных) внутримышечных инъекций.ХГЧ выводится почками, а 10-20% остается неизменным в моче, в то время как остаток, вероятно, выделяется в виде фрагмента бета-ядра.
Фармакодинамика.
Механизм действия
Хорионический гонадотропин человека (ХГЧ) представляет собой гликопротеин, содержащий альфа-субъединицу, которая является общей для лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ), и бета-субъединицу, которая является уникальной для ХГЧ. ХГЧ очищается из мочи беременных женщин и не является гомогенной. Даже высокоочищенные продукты содержат несколько фракций, различающихся содержанием и активностью сиаловой кислоты. Количество ХГЧ указывается в единицах биологической активности. Гормональный эффект хорионического гонадотропина основан на его способности стимулировать биосинтез половых стероидов в гонадах (яичниках и яичках). Действие ХГЧ качественно аналогично действию гипофизарного гонадотропина ЛГ. Однако ХГЧ имеет значительно более длительный период полувыведения и, таким образом, имеет больший эффект по сравнению с ЛГ в случае кумулятивного применения.Фармакодинамические эффектыВ яичниках ХГЧ стимулирует гранулезные, тека-, а также стромальные или лютеиновые клетки для поддержки выработки прогестерона и эстрадиола. В гранулезных клетках небольших фолликулов высокие дозы ХГЧ стимулируют преимущественно биосинтез эстрадиола, тогда как в гранулезных клетках зрелых, доминантных фолликулов и / или в лютеинизирующих гранулезных клетках высокие дозы ХГЧ стимулируют биосинтез прогестерона. Кроме того, ХГЧ стимулирует выработку биологически активных пептидов в яичнике, важных для регуляции репродукции (например, ингибин, релаксин, проренин, ингибитор активатора плазминогена).Введение 5000 МЕ до 10000 МЕ ХГЧ у женщин со зрелыми фолликулами (например, после стимуляции гонадотропином или кломифеном) индуцирует овуляцию примерно спустя 36 часов после внутримышечной инъекции.Клиническая эффективность и безопасностьВ клетках Лейдига у мужчин ХГЧ стимулирует выработку тестостерона и других стероидных гормонов, таких как 17-ОН прогестерон и эстрадиол. Однократное введение ХГЧ 5000 МЕ у мальчиков и мужчин увеличивает выработку тестостерона в два этапа, в результате чего достигается первая максимальная концентрация в плазме через 2-4 часа и вторая максимальная концентрация через 3-4 дня. Максимальное количество эстрадиола в сыворотке достигается примерно через 24 часа после введения ХГЧ. Этот принцип используется для дифференциальной диагностики крипторхизма, чтобы дифференцировать крипторхизм и анорхизм, а также для оценки функции яичек с гипогонадотропным гипогонадизмом.
Показания к применению
1500 МЕ
Андрология
Восстановление репродуктивной функции в случаях гипогонадотропного гипогонадизма (также в сочетании с ЧМГ (менопаузальный гонадотропин человека) или ФСГ (фолликулостимулирующий гормон)).
Педиатрия
Лечение неопущения семенника.
5000 МЕ
Терапия
Гинекология
У женщин с отсутствием овуляции или олигоовуляцией для запуска овуляции и лютеинизации после стимуляции роста фолликулов.
В рамках программы вспомогательных репродуктивных технологий (ВРТ), как например, экстракорпоральное оплодотворение: запуск конечного созревания фолликулов овуляции и лютеинизации после стимуляции роста фолликулов.
Педиатрия
Задержка полового созревания у мальчиков с сопутствующим гипогонадотропным гипогонадизмом.
Применение в диагностике
Андрология
Оценка функции яичек с гипогонадотропным гипогонадизмом перед стимулирующим лечением.
Педиатрия
Дифференциальная диагностика крипторхизма и анорхизма.
Способ применения
Способ применения
Препарат «ХОРАПУР» предназначен для внутримышечного введения. Непосредственно перед использованием порошок необходимо развести растворителем, поставляемым в комплекте.
Дозировка
1500 МЕ
Андрология
Лечение препаратом «ХОРАПУР» проводится под наблюдением врача с опытом лечения бесплодия.
В случаях гипогонадотропного гипогонадизма, 1 флакон «ХОРАПУР» 1500 МЕ дважды в неделю (соответствует 3000 МЕ хорионгонадотропина в неделю) в сочетании с ЧМГ или ФСГ в течение нескольких месяцев.
Лечение длится минимум 3 месяца лишь после этого можно ожидать какого-либо улучшения в сперматогенезе. Во время данного лечения, необходимо прекратить заместительную терапию тестостероном, а также необходим периодический мониторинг уровней тестостерона. Может потребоваться увеличение дозы ХГЧ для нормализации уровней тестостерона. При недостаточности ответа на терапию ХГЧ, дополнительно может потребоваться ЧМГ или ФСГ. После достижения улучшения в результате комбинированного лечения, в некоторых случаях, поддержание нормальных уровней можно обеспечивать монотерапией ХГЧ.
Педиатрия
Лечение неопущения семмеников необходимо завершить к концу первого года жизни.
Следующая дозировка рекомендована для детей первого полугодия жизни: 250 МЕ/доза (0,17 мл флакона 1500 МЕ) дважды в неделю в течение пяти недель.
5000 МЕ
Гинекология
Лечение препаратом «ХОРАПУР» проводится под наблюдением врача с опытом лечения бесплодия.
Лечение женщин с отсутствием овуляции или олигоовуляцией: Один флакон (5000 МЕ) или два флакона (10000 МЕ) препарата «ХОРАПУР» вводится спустя 24 -48 часов после достижения оптимальной стимуляции роста фолликулов. Пациенту рекомендуется половой контакт в день введения и на следующий день после введения препарата «ХОРАПУР».
В рамках программы вспомогательных репродуктивных технологий, как например, экстракорпоральное оплодотворение (ЭКО): Один флакон (5000 МЕ) или два флакона (10000 МЕ) препарата «ХОРАПУР» вводится спустя 24 -48 часов после последнего введения препарата ФСГ или ЧМГ, т.е. после достижения оптимальной стимуляции роста фолликулов.
Андрология
Для оценки функции яичек у пациентов с гипогонадотропным гипогонадизмом, 1 флакон (5000 МЕ) препарата «ХОРАПУР» однократно.
Педиатрия
Для индукции полового созревания у мальчиков с его задержкой, 1 флакон (5000 МЕ) препарата «ХОРАПУР» в неделю в течение 3месяцев.
Для дифференциальной диагностики мальчиков с крипторхизмом и анорхизмом, 1 флакон (5000 МЕ) препарата «ХОРАПУР» однократно.
Особые популяции
Почечная /печеночная недостаточность
Пациенты с почечной или печеночной функцией не включались в клинические исследования.
Побочные действия
Наиболее часто наблюдаемые неблагоприятные лекарственные реакции связаны с гиперстимуляцией яичников, т.е. СГЯ. Как правило, такие неблагоприятные реакции являются дозозависимыми и зависят от индивидуального ответа пациента на лечение.
Оценка неблагоприятных реакций основана на следующей классификации по частоте:
Очень часто (≥ 1/10)
Часто (≥ 1/100 до <1/10)
Нечасто (≥ 1/1000 до <1/100)
Редко (≥ 1/10000 до <1/1000)
Очень редко (до <1/10000)
Неизвестно (невозможно установить на основании имеющихся данных)
|
Системно-органный класс MedDRA |
Очень часто (≥ 1/10)
|
Часто (≥ 1/100 до <1/10)
|
Нечасто (≥ 1/1000 до <1/100)
|
Неизвестно (невозможно установить на основании имеющихся данных) |
|
Нарушения со стороны иммунной системы |
|
|
|
Реакции гиперчувствительности d |
|
Нарушения со стороны эндокринной системы |
Гинекомастия3 |
|
|
|
|
Нарушения со стороны обмена веществ и питания |
|
|
Электролиты и задержка жидкости |
|
|
Психические расстройства |
|
|
Депрессия, раздражительность, беспокойство |
|
|
Нарушения со стороны нервной системы |
Головная боль |
|
|
|
|
Нарушения со стороны сосудов |
|
Приливыb |
|
Тромбоэмболияс |
|
Нарушения со стороны желудочно-кишечного тракта |
|
Тошнота, боль в области живота, рвота |
Диарея |
|
|
Нарушения со стороны кожи и подкожных тканей |
|
Экзантема, обыкновенное акне |
|
Rash, erythema, pruritus |
|
Нарушения со стороны половых органов и молочной железы |
|
СГЯ легкой – умеренной степениc, набухание молочных желез, боль в яичках |
Тяжелый СГЯc |
Чувствительность и болезненность молочных желез |
|
Осложнения общего характера и реакции в месте введения |
Реакция в месте введения |
|
|
Пирексия, утомляемость, астения |
a Литературные данные, сообщаемые в отношении взрослых мужчин.
b О приливах сообщалось только у мужчин.
с Клинические признаки и симптомы СГЯ легкой и умеренной степени включают расстройства со стороны желудочно-кишечного тракта (дискомфорт в области живота, боль в области живота, вздутие, тошнота, рвота и/или понос), легкое и умеренное увеличение яичников, набор массы тела, кистоз яичников. В тяжелых случаях как о редких осложнениях сообщалось об асцитах, тазовой жидкости, плевральном экссудате, диспноэ, олигурии, тробоэмболических явлениях (артериальных и венозных) и перекруте яичника.
d Сообщалось о единичных случаях локализованных или генерализованных аллергических реакций, в том числе об анафилактическом шоке, а также о соответствующих симптомах.
Может наблюдаться увеличение размера полового члена и эрекции на фоне выработки тестостерона в результате индукции и/или пролиферативные изменения в простате.
Педиатрия
Периодически могут наблюдаться незначительные эмоциональные изменения у мальчиков, аналогичные наблюдаемые в начале полового созревания, которые исчезают после завершения лечения.
Противопоказания
Общие
Гиперчувствительность к активному веществу или какому-либо их вспомогательных веществ.
Гинекология
- Опухоли гипофиза или гипоталамуса
- Кисты яичников или увеличение яичников по причинам, отличным от поликистоза яичников.
- Гинекологические кровотечения неизвестной этиологии
- Карцинома яичников, матки или груди
- Внематочная беременность за последние 3 месяца
- Тромбоэмболические нарушения в активной фазе- Синдром гиперстимуляции яичников (СГЯ)
В следующих случаях, исход лечения вряд ли будет благоприятным, следовательно, препарат «ХОРАПУР» не назначается при:
- Первичном нарушении овуляции
- Патологии половых органов несовместимые с беременностью
- Миоме матки несовместимые с беременностью
- У женщин в постменопаузе
Педиатрия и андрология
Препарат «ХОРАПУР» не следует назначать в случаях с опухолями, зависимыми от половых гормонов.
Препарат «ХОРАПУР» не следует назначать для лечения неопущения семенников, известного органического происхождения (паховая грыжа, операция в паховой области, эктопическое яичко).
Лекарственные взаимодействия
Исследования взаимодействия у людей не проводились.
Особые указания
Общие
ХГЧ- терапия приводит к увеличению выработки андрогена и задержке жидкости. Пациенты с подозреваемым заболеванием сердца или почек, повышенным кровяным давлением, эпилепсией или мигренью (также в анамнезе) нуждаются в тщательном наблюдении из-за возможного наступления обострения или рецидива в результате применения препарата «ХОРАПУР» (смотреть раздел 4.8.).
Тромбоэмболия
У пациентов с общепризнанными факторами риска развития тромбоэмболических явлений, как например, личный или семейный анамнез, ожирением (Индекс массы тела > 30 кг/м2) или тромбофилией может быть повышен риск развития венозных или артериальных тромбоэмболических явлений во время или после лечения гонадотропинами. У данной группы пациентов, пользу лечения гонадотропинами необходимо взвесить с учетом рисков. Тем не менее, стоит отметить, что беременность сама по себе также несет риск развития тромбоэмболических явлений.
Гинекология
Перед началом лечения, при необходимости необходимо оценить причину бесплодия и предполагаемые противопоказания для беременности. В частности, необходимо обследовать пациента на гипотиреоз, недостаточность коры надпочечников, гиперпролактинемию, а также гипофизные и гипоталамические опухоли, и провести соответствующее специфическое лечение.
Синдром гиперстимуляции яичников (СГЯ)
У пациентов, проходящих стимуляцию роста фолликулов, может повышаться риск развития синдрома гиперстимуляции яичников (СГЯ) на фоне развития множественных фолликулов.
СГЯ – это медицинское явление, отличающееся от неосложненного увеличения яичников. СГЯ – это синдром, который может проявляться нарастающей степенью тяжести. Чрезмерный ответ яичников на терапию гонадотропинами в редких случаях является причиной СГЯ, если только ХГЧ не применяется для запуска овуляции. Поэтому, в случаях гиперстимуляции яичников, целесообразно отменить ХГЧ, и порекомендовать пациенту использовать барьерный метод контрацепции или воздержаться от половых контактов до следующего менструального кровотечения.
СГЯ может быстро прогрессировать (в течение 24 часов) или в течение нескольких дней представлять серьезное медицинское явление. Ранний СГЯ, как правило, развивается в течение первых 9 дней после запуска конечного созревания ооцитов на фоне ХГЧ, а поздний СГЯ может развиться при диагностике беременности. Как правило, СГЯ разрешается спонтанно с началом менструации. СГЯ может быть более тяжелым и более длительным, если наступает беременность. Следовательно, пациентам необходимо наблюдение минимум в течение двух недель после применения ХГЧ.
Клинические признаки и симптомы СГЯ легкой и умеренной степени, которая, как правило, разрешается спонтанно, включают расстройства со стороны желудочно-кишечного тракта (дискомфорт в области живота, боль в области живота, вздутие, тошнота, рвота и/или понос), легкое и умеренное увеличение яичников, набор массы тела, кистоз яичников. В тяжелых случаях, дополнительные симптомы включают серьезное увеличение яичников, диспноэ и олигурию. Клинические данные могут показать высокий уровень сывороточных половых стероидных гормонов, гиповолемию, сгущение крови, электролитный дисбаланс, асциты, гемоперитонеум, плевральный экссудат, гидроторакс и/или острый легочный дистресс. В очень редких случаях, тяжелый СГЯ может осложняться перекрутом яичника или тромбоэмболическими явлениями.
Для минимизации риска СГЯ, для всех пациентов рекомендуется тщательное наблюдение ответа яичников с использованием УЗИ, отдельно или в сочетании с анализом уровней эстрадиола, до и во время стимулирующей терапии. Соблюдение рекомендуемой дозировки препарата «ХОРАПУР», схемы лечения и тщательный мониторинг лечения минимизирует частоту развития СГЯ. В рамках программы вспомогательной репродуктивной технологии (ВРТ), аспирация всех фолликулов до овуляции может снизить вероятность развития СГЯ.
При развитии тяжелого СГЯ, лечение гонадотропином необходимо прекратить, если состояние сохраняется, пациента необходимо госпитализировать и назначить специфическое лечения ГЯ.
СГЯ развивается с высокой частотой у пациентов с поликистозом яичников (ПЯ).
Многоплодная беременность:
Многоплодная беременность, особенно на порядок выше, представляет повышенный риск неблагоприятных исходов для матери и ребенка.
У пациентов, проходящих индукцию овуляции гонадотропинами, вероятность многоплодной беременности повышается в отличие от естественного зачатия. В большинстве случаев многоплодной беременности рождаются близнецы. Для минимизации риска многоплодной беременности, рекомендуется тщательный мониторинг ответа яичников.
У пациентов, проходящих процедуры ВРТ, риск многоплодной беременности обычно связан с количеством размещенных эмбрионов, их качеством и возрастом пациента.
Пациент должен быть осведомлен о потенциальном риске многоплодных родов до начала лечения.
Внутриутробная гибель плода:
Частота внутриутробной беременности плода в результате выкидыша или аборта выше у пациентов, проходящих стимуляцию роста фолликулов в рамках ВРТ программы, чем у обычной популяционной группы.
Эктопическая беременность
У женщин с заболеванием маточных труб повышен риск эктопической беременности, независимо от того наступает ли беременность естественным путем или после лечения бесплодия. Сообщаемая частота эктопической беременности после ЭКО составляет 2-5%, по сравнению с 1-1,5% в обычной группе пациентов.
Неоплазмы репродуктивной системы:
Сообщалось о неоплазмах яичников и других органах репродуктивной системы, и о доброкачественных, и о злокачественных, у женщин, получивших многочисленные схемы лечения от бесплодия. Все еще не установлено увеличивает ли терапия гонадотропинами исходный риск развития таких опухолей у женщин с бесплодием.
Врожденные пороки развития:
Частота врожденных пороков развития после ВРТ может немного повышаться, в отличие от случаев после спонтанного зачатия. Это предположительно обусловлено разницей в родительских характеристиках (к примеру, возраст матери, характеристики спермы) и многоплодными беременностями.
Интерференция с лабораторными тестами
После применения препарата «ХОРАПУР» могут искажаться до 10 дней результаты иммунологического анализа ХГЧ в сыворотке/моче, а результаты теста на беременность могут быть ложноположительными.
Препарат «ХОРАПУР» содержит натрий, но менее 1 ммоль (23 мг) натрия на мл растворителя.
Применение препарата «ХОРАПУР» может давать положительные результаты теста допинг-контроля.
Применение препарата «ХОРАПУР» в виде допинга может представлять риски для здоровья.
Педиатрия
С осторожностью применять ХГЧ у мальчиков в препубертатном возрасте во избежание раннего замыкания зоны роста эпифиза или преждевременного полового развития, а также необходимо тщательное наблюдение развития скелета.
Применение ХГЧ было связано с симптомами воспаления и повышенным апоптозом половых клеток у мальчиков, получающих лечение по поводу неопущения яичек после первого года их жизни.
Фертильность
Препарат «ХОРАПУР» показан для лечения бесплодия (смотреть раздел 4.1.).
Беременность
Учитывая показания, препарат «ХОРАПУР» не следует применять во время беременности.
У мышей, получающих ХГЧ для индукции овуляции, наблюдалась повышенная дозозависимая эмбриональная летальность, в частности, предимплантационные потери (смотреть раздел 5.3.).
Грудное вскармливание
Учитывая показания, препарат «ХОРАПУР» не следует применять во время грудного вскармливания.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Препарат «ХОРАПУР» предположительно не оказывает никакого неблагоприятного влияния на способность вождения транспортных средств и управления механизмами.
Передозировка
Эффекты передозировки неизвестны, тем не менее, можно предполагать гиперстимуляцию яичников.
Форма выпуска и упаковка
По 1500 МЕ или 5000 МЕ лиофилизированного порошка для инъекций помещают во флаконы из бесцветного стекла с резиновыми крышками, укупоренными колпачками.
По 1 мл растворителя в ампулах из бесцветного стекла с контрольной точкой перелома.
По 3 флакона с препаратом и 3 ампулы с растворителем помещают в пластиковую контурную ячейковую упаковку. По 1 контурной ячейковой упаковке вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
Условия хранения
Хранить в защищенном от света месте при температуре не выше 25 °С в оригинальной упаковке. Не замораживать!
Хранить в недоступном для детей месте.
Срок хранения
3 года
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Ферринг ГмбХ, Германия
Wittland 11 , 24109 Kiel, Germany
Держатель регистрационного удостоверения
Ферринг ГмбХ, Германия
Wittland 11 , 24109 Kiel, Germany
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств от потребителей и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства:
Представительство «Ферринг Фармацевтикалс С.А.» в Республике Казахстан
Республика Казахстан, г. Алматы, 050022, Алмалинский район, ул. Наурызбай батыра, д. 99/1, офис 41б.
Тел.\факс: +7(727) 311-54-47
ЭНДОМЕТРИН (прогестерон)
УТВЕРЖДЕНА
Приказом председателя
Комитета Фармации
Министерства здравоохранения
Республики Казахстан
от «14» 11 2017 г.
№ N011802
Инструкция по медицинскому применению лекарственного средства
Эндометрин
Торговое название
Эндометрин
Международное непатентованное название
Прогестерон
Лекарственная форма
Таблетки вагинальные 100 мг
Состав
Одна таблетка содержит:
активное вещество – прогестерон микронизированный 100 мг
вспомогательные вещества: лактозы моногидрат, крахмал прежелатинизированный, кислота адипиновая, натрия гидрокарбонат, повидон, магния стеарат, натрия лаурилсульфат, кремния диоксид коллоидный.
Описание
Таблетки белого цвета, эллипсовидной формы, слегка отшлифованные, без запаха
Фармакотерапевтическая группа
Половые гормоны и модуляторы половой системы. Прогестагены. Производные прегнена. Прогестерон
Код АТС G03DA04
Фармакологические свойства
Фармакокинетика
При применении 100 мг препарата неэстрогенизированной женщине Cmax прогестерона в плазме крови достигается в течение 6 часов, а время полувыведения составляет 13 часов. При 2-х кратном применении Cmax прогестерона составляет 31,61±12,62 нмоль/л. Устойчивая концентрация прогестерона в плазме наблюдается при двукратном длительном применении препарата.
Прогестерон на 96 – 99 % связывается с сывороточными белками, преимущественно с альбумином и глобулином. Прогестерон первично метаболизируется в печени, преимущественно в прегнандиолы и прегнанолоны. Прегнанодиолы и прегнанолоны конъюгируются в печени с метаболитами глюкуронида и сульфатами. Метаболиты прогестерона, выделяющиеся в желчь, могут деконъюгироваться и далее метаболизироваться в кишечнике. Прогестерон выделяется через почки и печень.
Фармакодинамика
Эндометрин – прогестерон, естественный стероид секретирующийся ячниками, плацентой и адреналовыми железами. При наличии адекватного количества эстрогена, прогестерон трансформирует пролиферирующий эндометрий в секретирующий. Прогестерон необходим для увеличения восприимчивости эндометрия к имплантации эмбриона. После того, как эмбрион имплантируется, прогестерон поддерживает течение беременности.
Показания к применению
- гормонозаместительная терапия при лечении бесплодия и поддержки лютеиновой фазы
- при проведении вспомогательных репродуктивных технологий
- лечение патологических состояний, вызванных прогестиновой недостаточностью
Способ применения и дозы
Эндометрин предназначен для введения непосредственно во влагалище с помощью прилагаемого аппликатора.
Продолжительность лечения определяется характером и особенностями заболевания. В большинстве случаев при недостаточности прогестерона суточная доза Эндометрина составляет 200-300 мг, разделенная на 2-3 приема.
При лечении бесплодия и поддержки лютеиновой фазы, при проведении вспомогательных репродуктивных технологий
Рекомендуется принимать 100 мг Эндометрина 2 раза в день вагинально, начиная с момента овуляции в течение 10 – 12 недель гестации (до момента установления стабильной секреции прогестерона плацентой).
Правила введения Эндометрина
Побочные действия
Часто ( >l/100 и <l/10)
- головная боль
- тошнота, рвота, вздутие живота, боли в животе
Не часто (>l/1000 и <l/100)
- бессонница, головокружение
- слабость
- запор, диарея
- повышенная чувствительность, боль и набухание молочных желез
- нарушения со стороны наружных половых органов такие, как сухость, жжение, генитальный зуд, вагинальные выделения, кровотечения, умеренно выраженный вагинит, вагинальный микоз
- периферические отеки, отеки под глазами
- нарушения зрения и речи
- синкопальные состояния
- желтушность кожи и склер
- боли в икроножных мышцах, чувство онемения
- изменение массы тела
- пароксизмальная одышка, боли в грудной клетке, кашель с выделением крови
Противопоказания
- гиперчувствительность к прогестерону или другим компонентам препарата
- недиагностированное вагинальное кровотечение
- наличие злокачественной опухоли молочной железы и репродуктивных органов или подозрение на её наличие
- заболевания печени и печеночная недостаточность
- склонность к тромбозам, острые формы тромбофлебита или тромбоэмболии
- внематочная беременность или несостоявшийся аборт
- период лактации
- порфирия
С осторожностью
- заболевания сердечно-сосудистой системы
- артериальная гипертензия
- хроническая почечная недостаточность
- сахарный диабет
- бронхиальная астма
- эпилепсия
- мигрень
- депрессия
- гиперлипопротеинемия
Лекарственные взаимодействия
Эндометрин не рекомендуется к применению с другими вагинальными препаратами, поскольку это может повлиять на высвобождение прогестерона из вагинальных таблеток и его всасывание. В случае необходимости такого сочетания необходим шестичасовой интервал между введениями препаратов. Препараты с известным эффектом активации системы цитохрома Р450-3А4 (такие как, рифампицин, карбамазепин) могут усиливать элиминацию прогестерона. Кетоконазол (ингибитор цитохрома Р450-3А4) может увеличивать биодоступность прогестерона. Эффект сопутствующих препаратов для вагинального применения на длительность воздействия прогестерона не оценивался.
Особые указания
Следует тщательно обследовать пациентку, уделяя особое внимание органам малого таза и молочным железам. Поскольку прогестерон в некоторой степени способствует задержке жидкости, требуют систематического наблюдения состояния, провоцируемые этим фактором (например, эпилепсия, мигрень, астма, сердечная или почечная недостаточность). Пациентки с наличием депрессии в анамнезе требуют тщательного наблюдения, при усилении симптомов следует рассмотреть возможность отмены препарата. Применение Эндометрина должно быть прекращено при подозрении на появление ранних признаков инфаркта миокарда, цереброваскулярных нарушений, артериальной и венозной тромбоэмболии, тромбофлебита и тромбоза сосудов сетчатки.
С осторожностью применять при тяжелой печеночной недостаточности.
Некоторые литературные источники описывают снижение толерантности к глюкозе при применении комбинированных эстроген-гестагенных препаратов. Механизм этого эффекта неизвестен. Ввиду этого факта пациентки, имеющие в анамнезе сахарный диабет, также нуждаются в наблюдении в период проведения лечения. При появлении на коже пятен, связанных с воздействием солнечных лучей препарат следует применять с осторожностью.
Применение в период беременности или кормления грудью
Эндометрин применяется в первом триместре беременности при недостаточной выработке эндогенного прогестерона желтым телом. Риск врожденных аномалий, включая половые аномалии у детей обоих полов, связанный с воздействием экзогенного прогестерона во время беременности не установлен.
Следует с осторожностью применять в II и III триместре беременности из-за риска нарушения функции печени.
Прогестерон выявляется в грудном молоке. Эндометрин не следует применять в период лактации.
Педиатрия
Данные о применении этого препарата у детей отсутствуют. Данный препарат не предназначен для применения в педиатрии.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Препарат может вызывать сонливость и головокружение. Поэтому во время лечения следует соблюдать осторожность или воздержаться от управления транспортным средством или потенциально опасными механизмами.
Передозировка
Симптомы: усиление нежелательных эффектов, перечисленных в разделе «побочные действия».
Лечение: уменьшение дозы или прерывание применения препарата с назначением соответствующего симптоматического и поддерживающего лечения.
Форма выпуска и упаковка
По 30 таблеток помещают в пластиковый контейнер.
По 1 контейнеру вместе с вагинальным аппликатором и инструкцией по медицинскому применению на государственном и русском языках помещают в картонную коробку.
Условия хранения
В оригинальной упаковке при температуре не выше 25 оС
Хранить в недоступном для детей месте!
Срок хранения
5 лет
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
Ben Shimon Floris Ltd., Израиль,
Ind.Park, Misgav, 2017400, Израиль
Наименование и страна владельца регистрационного удостоверения Ferring Pharmaceuticals Ltd., Израиль
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
Представительство «Ферринг Фармацевтикалс С.А.»
в Республике Казахстан
Республика Казахстан
г. Алматы, 050022
ул. Наурызбай батыра
д.99/1, офис 41Б
Тел. /факс: +7(727)311 54 47
Адрес организации ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства
Республика Казахстан
г. Алматы, 050022
ул. Наурызбай батыра
д.99/1, офис 41Б
Тел. /факс: +7(727)311 54 47






